
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为 ,最高价氧化物的水化物的酸性Pb比C的 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得反应的离子方程式为 ;
PbO2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为_ _。若电解液中不加入Cu(NO3)2,主要缺点是 。
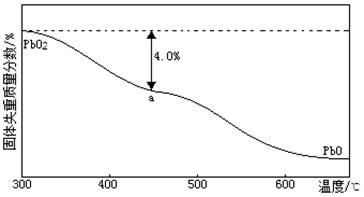
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%( )的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。
)的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。
【知识点】碳族元素性质 电解原理 化学计算 D1 F4
【答案解析】(1) 第六周期第ⅣA族 弱
(2)PbO2+4HCl(浓) 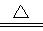 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
(3)PbO+ClO—= PbO2+Cl— Pb2++2H2O - 2e— = PbO2↓+ 4H+
不能有效利用Pb2+
(4)根据PbO2 PbO
PbO +
+ O2↑,有
O2↑,有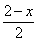 ×32=
×32=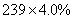 ,
,
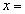
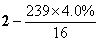 =1.4 ,根据mPbO2·nPbO,
=1.4 ,根据mPbO2·nPbO,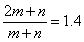 ,
,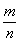 =
=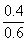 =
=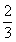
解析::(1)C、Pb属于同一主族元素,Pb比C多4个电子层,则Pb含有6个电子层,则Pb位于第六周期第IVA族;元素非金属性越强,其最高价氧化物的水化物酸性越强,非金属性C>Pb,所以最高价氧化物的水化物酸性Pb的比C的弱;
(2)PbO2与浓盐酸共热生成黄绿色气体,说明二者反应生成氯气,反应方程式为PbO2+4HCl(浓)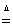 PbCl2+Cl2↑+2H2O;
PbCl2+Cl2↑+2H2O;
(3)PbO和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为PbO+ClO-=PbO2+Cl-;电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+;阴极上铜离子放电生成Cu单质,所以阴极上有铜析出;若电解液中不加入Cu(NO3)2,阴极上铅离子得电子生成铅,电极反应式为Pb2++2e-=Pb;Pb2+生成PbO2的量减少,则Pb2+利用率降低;
(4)根据PbO2 PbO
PbO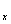 +
+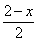 O2↑,有
O2↑,有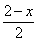 ×32=
×32=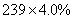 ,
,
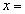
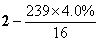 =1.4 ,根据mPbO2·nPbO,
=1.4 ,根据mPbO2·nPbO,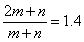 ,
,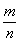 =
=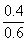 =
=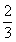
【思路点拨】本题考查了碳族元素性质,涉及离子反应、电解原理、化学计算等,(3)(4)小题比较新颖。


科目:高中化学 来源: 题型:
现有下列仪器或装置,请回答下列问题:
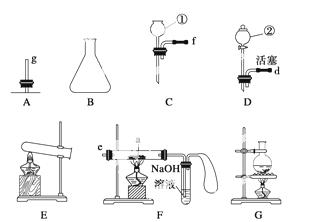
(1)仪器①的名称是____________________,②的名称是______________________。
(2)用上图仪器组装成气体发生装置:用KClO3和MnO2制O2应选的装置是________(填字母);用废H2O2与MnO2制O2,并控制产生O2的速率,应选________(填字母)。
(3)若用装置X进行“排空气法”收集制取的O2,氧气应从__________(填“b”或“c”)端导入。若瓶中装满水,用排水法收集氧气,氧气应从__________(填“b”或“c”)端导入。
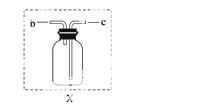
(4)若用F装置进行CO还原Fe2O3的实验,实验室制取CO的方法一般采取甲酸脱水法(HCOOH CO↑+H2O),用纯净的CO完成该实验,
CO↑+H2O),用纯净的CO完成该实验,
①除F、X外还需要的装置有________,X中应加入的试剂是________,X与其它导管连接的顺序是______________________(填导管口的序号);
②实验时,a处的可能的现象为___________________________________________;
F装置中气球的作用是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验室制取氯化氢气体的方法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)

Ⅱ.实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50 ℃~80 ℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:____。
(2)硫酸溶液过稀会导致_________。
(3)采用水浴加热的原因是___________。
(4)反应时铁屑过量的目的是(用离子方程式表示) 。
(5)溶液趁热过滤的原因是__________。 塞紧试管口的目的是__________。
(6)静置冷却一段时间后,在试管中观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下 列各装置图的叙述中,正确的是
列各装置图的叙述中,正确的是
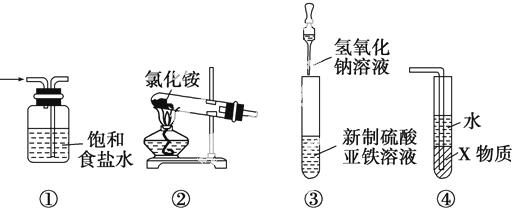
A.装置①是洗气装置,除去氯气中的氯化氢
B.实验室用装置②制取氨气
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④中X若为四氯化碳,可用于吸收氨气,并防止倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组利用如下仪器组装一套制备氮化硼晶体的装置。反应原理是B2O3+2NH3高温,F2BN+3H2O。(已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水。)
(1)各仪器接口由左到右的连接顺序为____________________________________。
(2)实验过程分为如下操作:①提纯BN ②滴加浓氨水 ③添加药品 ④连接装置 ⑤加热管式电炉 ⑥检查装置气密性 ⑦取出反应混合物 ⑧停止加热,继续通一段时间的氨气。则正确的操作顺序为________________________________________________(填序号)。
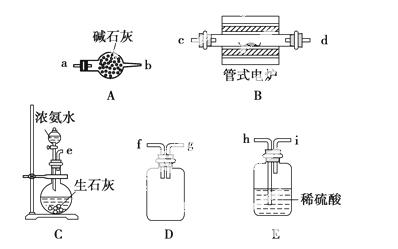
(3)仪器A的名称为________,装置D的作用是_______________________________,
若去掉装置E会导致______________________________________________________。
(4)装置C能产生氨气的原因有_____________________________________________
(答出其中一项即可)。
(5)管式电炉加热反应前必须进行的一步操作是________________________________,
反应结束时,继续通一段时间氨气的目的是__________________________________。
(6)除去产物中未反应的B2O3并得到纯净的BN固体的实验操作是
____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关叙述正确的是( )
A.明矾在水中生成的Al(OH)3胶体有吸附性,因此常用明矾对水进行净化和消毒
B.二氧化硅具有较强的导电性,可用于制造光导纤维
C.CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物
D.常温下干燥的氯气不与铁反应,所以可以用钢瓶贮存液氯
查看答案和解析>>
科目:高中化学 来源: 题型:
“化学是一门中心学科,与社会、生活、科研密切的关系”。下列叙述中,不正确的是
A.大量使用燃煤发电是形成雾霾的主要原因
B.天然气、煤气大量泄漏遇到明火会爆炸
C.利用化学反应可实现12C到14C的转化
D.晶体硅可用于光伏发电、制造芯片
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有下列6种离子中的某几种:Cl-、S、C、N、Na+、K+。为确认溶液组成进行如下实验:
(1)200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12 L(已换算成标准状况,假定产生的气 体全部逸出)。
体全部逸出)。
由此可以得出关于原溶液组成的正确结论是( )
A.一定存在S、C、N,可能存在Cl-、Na+、K+
B.一定存在S、C、N、Cl-,一定不存在Na+、K+
C.c(C)=0.01 mol·L-1,c(N)>c(S)
D.如果上述6种离子都存在,则c(Cl-)>c(S)
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)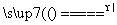 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式:_____________________________________________。
(2)在反应中MnO2发生________(填“氧化”或“还原”,下同)反应,Cl2是__________产物。
(3)当0.1 mol MnO2参加反应时,转移的电子数为______,被氧化的HCl为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com