
【题目】钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C![]() TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg
TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg![]() Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为_______________________________。
(2)与CO互为等电子体的离子为_____(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有__________ 。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于______(填“原子”、“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 __________。
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如右图所示,则其中Ti4+的配位数为__________。

【答案】3d24s2CN-(或NO+、C22-)CO2分子产生白色沉淀[Co (NH3)5SO4]Br6
【解析】
(1)根据构造原理,由原子序数即可写出基态原子的电子排布式,进而可写出价电子排布式;
(2)根据等电子体的概念写出符合题目要求的等电子体;
(3)可根据分子的构型来判断碳的杂化方式,四面体形属于sp3杂化,平面形中的碳属于sp2杂化,直线形中的碳属于sp杂化;
(4)根据题目中提供的物理性质来判断晶体类型;
(5)络合物由內界和外界组成,络合物溶于水发生电离生成內界离子(络离子)和外界离子,与BaCl2或AgNO3溶液反应的离子肯定为外界离子,由此可判断络合物的组成;
(6)观察晶胞,数数Ti周围距离最近的O的个数即为Ti的配位数。
(1)钛为22号元素,基态电子排布式为:[Ar]3d24s2,则基态钛原子的价电子排布式为3d24s2,因此,本题正确答案是:3d24s2;
(2)CO为双原子分子,价电子总数为10,则CO的等电子体为离子的为:CN-(或NO+、C22-),因此,本题正确答案是:CN-(或NO+、C22-);
(3)在CH2Cl2、C6H6、CO2、C2H4中,分子构型分别为四面体形、平面三角形、直线形、平面形,所以碳原子的杂化方式分别为sp3、sp2、sp、sp2杂化,采取sp2杂化的分子有C6H6、C2H4,所以sp杂化的是CO2,因此,本题正确答案是:CO2;
(4)因TiCl4在常温下是无色液体,说明熔点低,在水或潮湿空气中易水解而冒白烟,说明钛离子为弱碱阳离子,由此可判断TiCl4是由共价键结合的分子,晶体类型属于分子晶体,
因此,本题正确答案是:分子;
(5)由[Co(NH3)5Br]SO4可以知道,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合成白色沉淀。加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,若加入AgNO3溶液时,产生淡黄色沉淀,说明溴离子在外界,因此另一配合物的化学式为[Co (NH3)5SO4]Br,
因此,本题正确答案是:产生白色沉淀;[Co (NH3)5SO4]Br;
(6)观察晶胞结构,可以知道每个钛周围距离最近的氧原子有6个,即钛的配位数为6,
因此,本题正确答案是:6。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点。如图为镁—次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是
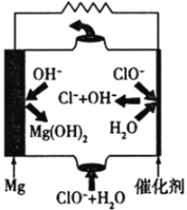
A. 该燃料电池中镁为负极,发生氧化反应
B. 正极反应式为ClO―+H2O+2e―=Cl―+2OH―
C. 放电过程中OH―移向正极移动
D. 电池总反应式为Mg+ClO―+H2O=Mg(OH)2+Cl―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡萝卜中具有较多的胡萝卜素,它是人体主要营养之一,α-胡萝卜素的结构为: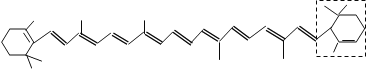 。有机化学中有时可以将结构简式中的C和H省略不写,如
。有机化学中有时可以将结构简式中的C和H省略不写,如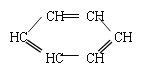 可写为:
可写为:![]() ;又如
;又如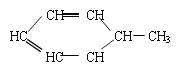 可写为:
可写为:![]() 。
。
(1)写出α-胡萝卜素的化学式______________。
(2)1mol胡萝卜素最多能与__________molBr2发生加成反应。
(3)β-胡萝卜素与α-胡萝卜素互为同分异构体,且只是虚线框内部分不同,但碳架结构相同,写出β-胡萝卜素虚线框内可能的结构简式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用下列装置制取收集纯净的氯气,并研究其性质。请回答下列问题。

(1)装置甲中仪器A的名称是________,丙中应装的溶液是_______ ,甲装置中发生反应的离子方程式为_____________ 。制取收集纯净氯气的装置接口连接顺序是a→ …→g(补充完整)_________。
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
I方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
Ⅱ方案:采用酸碱中和滴定法测定。
Ⅲ方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
继而进行下列判断和实验:
①判定I方案不可行,理由是__________________;
②进行Ⅱ方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00mL于锥形瓶中,若锥形瓶中存有少量水,对实验结果是否有影响?_____填“是”或“否” )。用0.10 molL-1NaOH标准溶液滴定,消耗NaOH标准溶液的体积如图所示 ,其读数为 _____mL.

b.平行滴定后获得实验结果
③判断Ⅲ方案的实验结果___________(填“偏大”、“偏小”或“准确”)。[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11
(3) 某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体,且A气体有颜色)。

(1)该反应的的化学方程式为________________。
(2)反应开始至2分钟时,B的平均反应速率为_________。
(3)下列措施能使该反应加快的是_______(仅改变一个条件)。
a.降低温度 b.缩小容积 c.使用效率更高更合适的催化剂
(4)能说明该反应已达到平衡状态的是___________(填序号)。
①单位时间内生成n mol B的同时生成2n mol C
②单位时间内生成n mol B的同时生成2n mol A
③容器内压强不再随时间而发生变化的状态
④用C、A、B的物质的量浓度变化表示的反应速率的比为2:2:1的状态
⑤混合气体的颜色不再改变的状态 ⑥混合气体的密度不再改变的状态
⑦v逆(A)=v正(C)
(5)由图求得平衡时A的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):

①电解质溶液为稀H2SO4时上述装置中灯泡亮,此时Al电极上发生反应的电极反应式为:____________________;
②电解质溶液为NaOH溶液时,灯泡_______(填“亮”或“不亮”)。若灯泡亮,则Mg电极上发生的电极反应式为:___________________;Al电极上发生反应的电极反应式为:________________;
(2)氢氧燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为:________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)。
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入Cl2,将Br-氧化,该反应的离子方程式是____。
(3)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是________,转Mg(OH)2化为MgCl2的离子方程式是____________。
②由无水MgCl2制取Mg的化学方程式是________________________。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
![]()
①灼烧海带时所用的主要仪器名称是________________。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式_______________________。
反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,B为地壳中含量最多的元素,C是原子半径最大的短周期主族元素,C与D形成的离子化合物CD是常用的调味品。填写下列空白:
(1)A B2的结构式_______________;C元素在周期表中的位置第_______周期________族
(2)B、C组成的一种化合物与水发生化合反应的化学方程式为:____________________
(3)如图所示,电解质a溶液为含有CD的饱和溶液。X为石墨电极,Y为铁电极,接通直流电源。
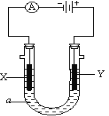
X电极的电极反应式为________________________。
Y电极的电极反应式为________________________。
(4)常温下,相同体积的0.2mol·L—1CD溶液与0.1mol·L—1 C2AB3溶液中,总离子数目较多的是______________溶液(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com