
【题目】溶液、胶体、浊液三种分散系的本质区别是( )
A. 分散质粒子直径大小 B. 是否有丁达尔效应
C. 是否均一、稳定、透明 D. 是否能透过滤纸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】纳米铜有很多奇特的性质,比如超塑延展性,在室温下可拉长50多倍而不出现裂纹,铜纳米晶体的这种机械特性为制造常温下的弹性物质开辟了光明前景。此外,纳米铜还用作热氨发生器、凝胶推进剂、燃烧活性剂、催化剂、水清洁吸附剂、烧结活性剂等。纳米铜比普通铜更容易与氧气发生反应,常温下在空气中可以自燃。以下是纳米铜的一种制备工艺,用于制备50~100nm的铜粉。

已知:油酸(C17H33COOH)难溶于水,可溶于乙醇。
步骤①中发生的反应为:2C17H33COOH +Cu2+![]() Cu(C17H33COO)2 +2H+
Cu(C17H33COO)2 +2H+
步骤②中发生的反应为:2Cu(C17H33COO)2 + C6H12O6+5OH- =Cu2O+C5H11COO-+4C17H33COO-
回答下列问题:
(1)将纳米铜粉加人燕馏水中,搅拌均匀后,得到的分散系类型是_________
(2)步骤①中调节pH5.5~6.0时,萃取率最高,pH不能过大也不能过小,若过小则______,若过大则__。
(3)NaH2PO2中P的化合价是_______,在步骤③中被氧化得到的产物是NaH2PO3,该反应的化学方程式是_____。已知NaH2PO2为正盐且溶液呈碱性.NaH2PO2溶液呈碱性原因用离子方程式可表示为_。
(4)用乙醇清洗产物的目的是__________。
(5)真空干燥产品的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中提供的数据(25 ℃),判断下列说法正确的是
化学式 | 电离常数 |
HClO | Ka=3.0×10-8 |
H2CO3 | Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
A. 向氯水中加入硫酸,可增强杀菌效果
B. 温度升高,次氯酸的电离常数增大
C. 25 ℃时,ClO-的水解常数为3.0×10-6
D. 要提高氯水中HClO的浓度,可加入足量的Na2CO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4
+NH4HSO4
![]() + Cu(OH)2
+ Cu(OH)2![]()
![]() +H2O
+H2O
制备苯乙酸的装置示意图如图(加热和夹持装置等略)。
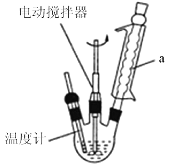
己知: 苯乙酸的熔点为76.5℃,可升华,易溶于热水,微溶于冷水,溶于乙醇。
请回答下列问题:
(1)将装置中的溶液加热至100℃,缓缓滴加40g 苯乙腈到硫酸溶液中,然后升温至130℃继续反应,在装置示意图中,仪器a的名称是________,其作用是_____________;
(2)反应结束后加适量冷水,可分离出苯乙酸粗品,其加入冷水的目的是____________;下列仪器中可用于分离苯乙酸粗品的是_______(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)如果要将苯乙酸粗品进一步提纯,你选择的实验方法是___________(填二种方法)。
(4)用CuCl2·2H2O和NaOH 溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________;
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,一定能在无色溶液中大量共存的是( )
A. Cu2+、Ba2+、Cl-、SO42- B. K+、Na+、OH-、Cl-
C. Na+、H+、SO42-、OH- D. H+、Na+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在一定条件下反应产生等物质的量的气体时,消耗酸的物质的量最少的是
A. 碳与浓硫酸 B. 二氧化锰与浓盐酸
C. 铁与稀硫酸 D. 铜与稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用钒炉渣(主要含FeO·V2O5,还有少量SiO2、P2O5等杂质)提取V2O5的流程如下:

(1)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,该过程中被氧化的元素是_______________;浸出渣的主要成分为____________________(填化学式)。
(2)用MgSO4溶液除硅、磷时,滤渣的主要成分为__________。
(3)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示,210℃时,剩余固体物质的化学式为_____________________。

(4)由V2O5冶炼金属钒采用铝热法,引发铝热反应的实验操作是__________________.
(5)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,俯视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com