
【题目】某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
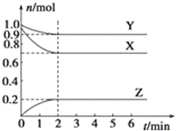
(1)该反应的化学方程式为:____。
(2)反应开始至2min,用X表示的平均反应速率为_____。
(3)反应开始至2min时,Y的转化率为___。
(4)对于上述反应当改变下列条件时,反应速率会发生什么变化(填“增大”、“减小” 或“不变”)?
①降低温度:_____;
②保持容器的体积不变,增加X的物质的量:____;
③保持容器的体积不变,增加He:____;
④增大容器的体积:____。
【答案】3X+Y![]() 2Z 0.075 mol/(Lmin) 10% 减小 增大 不变 减小
2Z 0.075 mol/(Lmin) 10% 减小 增大 不变 减小
【解析】
(1)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,2min后X、Y物质的量不变,属于可逆反应,根据参加反应的物质的物质的量之比等于化学计量数之比确定化学计量数;
(2)2min末X的物质的量为0.7mol,根据v=![]() 计算X表示的速率;
计算X表示的速率;
(3)Y的转化率=![]() ×100%;
×100%;
(4)结合影响反应速率的因素分析。
(1)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,2min后X、Y物质的量不变,属于可逆反应,当反应进行到2min时,△n(Y)=0.1mol,△n(Z)=0.2mol,△n(X)=0.3mol,则△n(Y):△n(Z):△n(X)=1:2:3,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:Y+3X![]() 2Z;
2Z;
(2)2min末X的物质的量为0.7mol,X表示的反应速率= =0.075mol/(Lmin);
=0.075mol/(Lmin);
(3)当反应进行到2min时,△n(Y)=0.1mol,则Y的转化率为![]() ×100%=10%;(4)①降低温度,反应速率减小;
×100%=10%;(4)①降低温度,反应速率减小;
②保持容器的体积不变,增加X的物质的量,X浓度增大,反应速率增大;
③保持容器的体积不变,增加He,反应混合物各组分浓度不变,反应速率不变;
④增大容器的体积,压强减小,各组分浓度减小,反应速率减小。


科目:高中化学 来源: 题型:
【题目】下列反应是在溶液中进行的反应,按下列要求作答:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用双线桥表示反应中电子的转移情况___;MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)该反应的氧化剂是___,发生了___反应。
(3)将其改写成离子方程式___。
(4)当有2molHCl消耗时,转移的电子的物质的量为___mol。
(5)浓盐酸在该反应中表现的性质是___(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、101 kPa下,0.5 mol辛烷C8H8燃烧生成二氧化碳和液态水时放出2 759 kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
O2(g)===8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)===8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
O2(g)===8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D. 2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=+11 036 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是
2H2(g)+O2(g)==2H2O(l)
(l)请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点______________________。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+3B(g)![]() 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.01mol/(L·s)B.v(B)=0.02mol/(L·s)
C.v(B)=0.60mol/(L·min)D.v(C)=1.00mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喘通(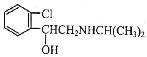 )是我国最早自主研发生产的药物之一,主要用于支气管哮喘的治疗。其合成路线如图:
)是我国最早自主研发生产的药物之一,主要用于支气管哮喘的治疗。其合成路线如图:
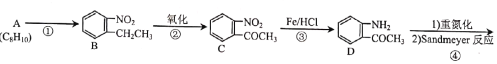
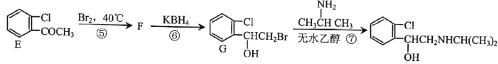
(1)A的化学名称为___,反应①的试剂与条件为__,反应③的反应类型为___。
(2)E中含氧官能团的名称为__。
(3)F的结构简式为___。
(4)反应⑦的化学方程式为__。
(5)B的同分异构体H是含有氨基、能与NaHCO3溶液反应放出气体的芳香族化合物。则H的结构有__种(不含立体异构)。其中核磁共振氢谱有5组峰,且峰面积之比为1:2:2:2:2的是__(写出其中一种的结构简式)。
(6)《神农本草经》中记载麻黄能“止咳逆上气”。从麻黄中提取的麻黄碱也可用于治疗支气管哮喘,其结构简式为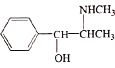 。
。
已知:![]() + CH3COCl
+ CH3COCl![]() +HCl。设计以苯、CH3CH2COCl、CH3NH2为原料合成麻黄碱的合成路线__。(无机试剂任选)
+HCl。设计以苯、CH3CH2COCl、CH3NH2为原料合成麻黄碱的合成路线__。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓![]() 为黑灰色固体,是重要的半导体材料,用砷化镓制成的半导体器件具有低温性能好、抗辐射能力强等优点。请回答下列问题:
为黑灰色固体,是重要的半导体材料,用砷化镓制成的半导体器件具有低温性能好、抗辐射能力强等优点。请回答下列问题:
(1)基态![]() 原子核外电子占据最高能级的电子云轮廓图为________形。
原子核外电子占据最高能级的电子云轮廓图为________形。
(2)砷化镓可由![]() 和
和![]() 制得。在常温常压下,
制得。在常温常压下,![]() 为无色透明液体,则
为无色透明液体,则![]() 固体属于________晶体。
固体属于________晶体。![]() 的沸点低于
的沸点低于![]() 的原因为________。
的原因为________。
(3)亚砷酸![]() 是一种三元弱酸,分子中含有羟基数目为________个;根据价层电子对互斥理论推测
是一种三元弱酸,分子中含有羟基数目为________个;根据价层电子对互斥理论推测![]() 的空间构型为________;与
的空间构型为________;与![]() 互为等电子体的一种分子为________。
互为等电子体的一种分子为________。
(4)![]() 的熔点为
的熔点为![]() ,晶胞结构如图所示:
,晶胞结构如图所示:
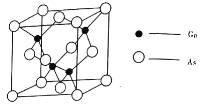
①在![]() 晶体中,镓原子的配位数是________,与同一个镓原子相连的砷原子构成的空间构型为________。
晶体中,镓原子的配位数是________,与同一个镓原子相连的砷原子构成的空间构型为________。
②若砷化镓晶胞边长为![]() 。则该晶体密度为________
。则该晶体密度为________![]() (用含
(用含![]() 的代数式表示)。
的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.72L标况下的氯气通入到500ml一定物质的量浓度的氢氧化钠溶液中,恰好完全反应。则
①该氢氧化钠溶液的浓度是多少?②生成次氯酸钠的质量是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com