
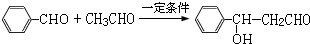 .
. .
. .
.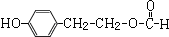
 .
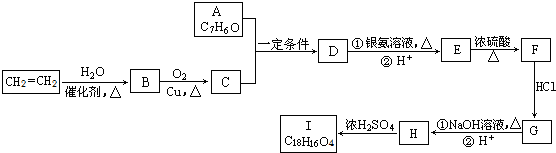
. 分析 乙烯与水发生加成反应生成B为CH3CH2OH,乙醇催化氧化生成C为CH3CHO.A的分子式为C7H6O,与乙醛发生信息中的加成反应生成D,则A含有醛基,D经过系列转化得到I,且I分子结构中含有三个六元环,故A中含有六元环,故A为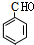 ,则D为
,则D为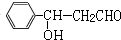 ,D发生银镜反应、酸化得到E为
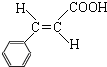
,D发生银镜反应、酸化得到E为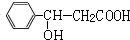 ,E在浓硫酸、加热条件下发生消去反应生成F为
,E在浓硫酸、加热条件下发生消去反应生成F为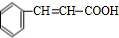 ,根据I分子结构中含有3个六元环可知,F与HCl发生加成反应,氯原子加在羧基邻位碳上,则G为
,根据I分子结构中含有3个六元环可知,F与HCl发生加成反应,氯原子加在羧基邻位碳上,则G为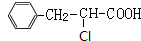 ,G在氢氧化钠水溶液、加热条件下发生水解反应生成、酸化得到H为
,G在氢氧化钠水溶液、加热条件下发生水解反应生成、酸化得到H为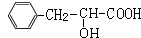 ,2分子H发生酯化反应形成环酯I为
,2分子H发生酯化反应形成环酯I为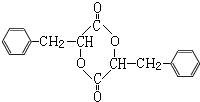 ,据此解答.
,据此解答.
解答 解:乙烯与水发生加成反应生成B为CH3CH2OH,乙醇催化氧化生成C为CH3CHO.A的分子式为C7H6O,与乙醛发生信息中的加成反应生成D,则A含有醛基,D经过系列转化得到I,且I分子结构中含有三个六元环,故A中含有六元环,故A为 ,则D为
,则D为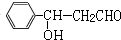 ,D发生银镜反应、酸化得到E为
,D发生银镜反应、酸化得到E为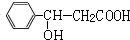 ,E在浓硫酸、加热条件下发生消去反应生成F为
,E在浓硫酸、加热条件下发生消去反应生成F为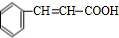 ,根据I分子结构中含有3个六元环可知,F与HCl发生加成反应,氯原子加在羧基邻位碳上,则G为
,根据I分子结构中含有3个六元环可知,F与HCl发生加成反应,氯原子加在羧基邻位碳上,则G为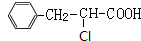 ,G在氢氧化钠水溶液、加热条件下发生水解反应生成、酸化得到H为
,G在氢氧化钠水溶液、加热条件下发生水解反应生成、酸化得到H为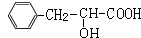 ,2分子H发生酯化反应形成环酯I为
,2分子H发生酯化反应形成环酯I为 .
.
(1)D为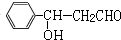 ,所含官能团有:醛基、羟基,CH2=CH2→B的反应类型是:加成反应,
,所含官能团有:醛基、羟基,CH2=CH2→B的反应类型是:加成反应,
故答案为:醛基、羟基;加成反应;
(2)A+C→D的化学反应方程式是: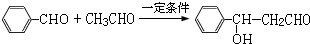 ,
,
故答案为: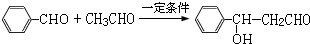 ;
;
(3)F为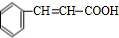 ,其反式结构式是:
,其反式结构式是: ,
,
故答案为: ;
;
(4)H→I的化学反应方程式是: ,
,
故答案为: ;
;
(5)a.A是苯甲醛、C为CH3CHO,二者不属于同系物,故错误;
b.E为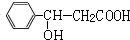 ,含有羧基、羟基,可以发生缩聚反应,F为
,含有羧基、羟基,可以发生缩聚反应,F为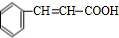 ,含有碳碳双键,可以发生加聚反应,故正确;
,含有碳碳双键,可以发生加聚反应,故正确;
c.E为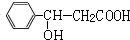 ,H为
,H为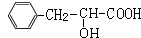 ,二者互为同分异构体,故正确;
,二者互为同分异构体,故正确;
d.I属于酯类物质,不易溶于水,故错误,
故选:bc;
(6)E(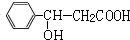 )的同分异构体有多种,符合以下要求:
)的同分异构体有多种,符合以下要求:
①苯环上只有两个对位取代基;②FeCl3溶液发生显色反应,含有酚羟基;③能发生银镜反应,④能发生水解反应,说明含有甲酸生成的酯基(-OOCH),故符合条件的同分异构体的结构简式为: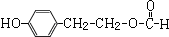
 ,
,
故答案为: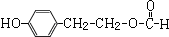
 .
.
点评 本题考查有机物的推断,需要学生对给予的信息进行利用,结合I的分子式与结构特点、反应条件,采取正逆推法相结合进行推断,较好的考查学生分析推理能力,需要学生熟练掌握官能团的性质与转化,难度中等.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
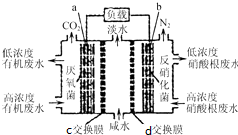 一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )
一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )| A. | 电子从a极经负载到b极 | |
| B. | c为氯离子交换膜,d为钠离子交换膜,中间室可用作海水淡化 | |
| C. | 负极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | 反应后将左右两室溶液混合较反应前两室溶液混合的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
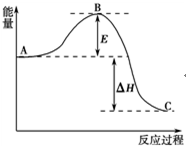 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化.
氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L氧气与金属钠完全反应,转移的电子数一定是4NA | |
| B. | 常温常压下,1.7gH2O2中含有电子数为0.9NA | |
| C. | 1L 0.2 mol•L-1 FeCl3溶液中,含有Fe3+粒子数为0.2 NA | |
| D. | 标准状况下,0.1mol 甲苯所含C-C键数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| B. | 硫酸厂按照规定已经处理除去了重金属离子的酸性废水,可直接排放入湖水中 | |
| C. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 合金超导材料是指熔合两种或两种以上的金属元素并形成具有超导电性的超导材料,如铌一钛(Nb-Ti)合金,它的熔点一般比纯钛要低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能改变反应限度 | |
| B. | 升高温度,则反应速率减慢 | |
| C. | 四种物质的量浓度相等时,则一定达到了该反应的限度 | |
| D. | 各物质的浓度不再发生变化时,则达到化学反应的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{△}^{-H_{2}O}$CH3CH=CHCHO
$→_{△}^{-H_{2}O}$CH3CH=CHCHO +CO$→_{△}^{AlCl_{3},HCl}$
+CO$→_{△}^{AlCl_{3},HCl}$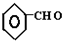

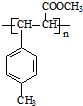 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com