
A、CH3CH3+Cl2
| ||
| B、由油脂得到甘油,由淀粉得到葡萄糖;均发生了水解反应 | ||
| C、Cl2+2Br-═2Cl-+Br2,Zn+Cu2+═Zn2++Cu,均为单质被还原的置换反应 | ||
| D、2Na2O2+2H2O═4NaOH+O2↑,Cl2+H2O═HCl+HClO,均为水作还原剂的氧化还原反应 |
| 光 |


科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol?L-1盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、①④⑤⑥ |
| C、②③④⑥ | D、①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2S+SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为2:1 | ||||
| B、4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2 | ||||
C、3I2+6KOH
| ||||
D、2FeS+6H2SO4(浓)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
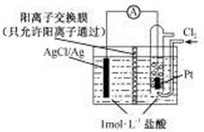 某电源装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
某电源装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )| A、正极反应为AgCl+e-═Ag+Cl- |
| B、放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C、若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D、当电路中转移0.01mol e-时,交换膜左则溶液中约减少0.02mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A、0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L?min) |
| B、6~10min的平均反应速率:v(H202)<3.3×10-2mol/(L?min) |
| C、反应至6min时,c(H2O2)=0.30mol/L |
| D、反应至6min时,H2O2分解了50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
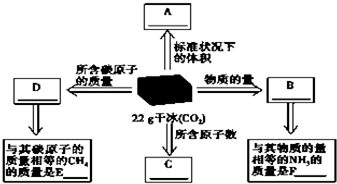 (1)干冰是固态CO2的俗称,常用做人工降雨,22g干冰与A、B、C、D有如图所示的转化关系,请完成图中方框.
(1)干冰是固态CO2的俗称,常用做人工降雨,22g干冰与A、B、C、D有如图所示的转化关系,请完成图中方框.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com