
分析 (1)向氨水中加入硫酸铵,抑制一水合氨电离;
(2)溶液呈中性,则c(H+)=c(OH-),根据电荷守恒判断离子浓度;
(3)若向氨水中加入硫酸,二者恰好反应生成硫酸铵,硫酸铵是强酸弱碱盐,其溶液呈酸性,结合电荷守恒判断离子浓度大小顺序.
解答 解:(1)向氨水中加入硫酸铵,铵根离子浓度增大抑制一水合氨电离,平衡向左移动,则氢氧根离子物质的量减小,一水合氨分子物质的量增大,所以溶液中$\frac{[O{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$减小,故答案为:向左;减小;
(2)混合溶液呈中性,所以c(H+)=c(OH-),根据电荷守恒得c(NH4+)+c(H+)=2c(SO42-)+c(OH-),所以c(SO42-)=$\frac{1}{2}$c(NH4+)=$\frac{1}{2}$amol•L-1,
故答案为:$\frac{1}{2}$amol•L-1;
(3)若向氨水中加入硫酸,二者恰好反应生成硫酸铵,反应的离子方程式为NH3•H2O+H+=NH4++H2O,硫酸铵为强酸弱碱盐,铵根离子水解而使其溶液呈酸性,pH<7,水解离子方程式为NH4++H2O?NH3•H2O+H+,溶液呈酸性则c(H+)>c(OH-),溶液中存在电荷守恒c(H+)+c(NH4+)=2c(SO42-)+c(OH-),所以 c(NH4+)>c(SO42-),铵根离子水解程度较小,所以c(SO42-)>c(H+),则离子浓度大小顺序是 c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:NH3•H2O+H+=NH4++H2O;<;NH4++H2O?NH3•H2O+H+;c(NH4+)>c(SO42-)>c(H+)>c(OH-).
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,弱电解质的电离常常与离子浓度大小比较、酸碱混合溶液定性判断联合考查,结合物料守恒和电荷守恒解答即可,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯气与氯化亚铁溶液的反应:Cl2+2Fe2+═2Cl-+2Fe3+ | |
| B. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| C. | 三氯化铁溶液与氢氧化钡溶液反应:FeCl3+3OH-═Fe(OH)3↓+3Cl- | |
| D. | 锌粒与稀醋酸反应:Zn+2H+═Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 57.5mL | B. | 55mL | C. | 52.5mL | D. | 50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 欲配制1.00L 1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
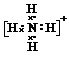 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 1molN2与过量H2反应,转移6NA个电子 | |
| C. | 1L1.0mo1/L的Na2SO4水溶液中含有的氧原子数为4NA | |
| D. | 1L0.1mol/L的氨水中有NA个NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com