
【题目】电导率可用于衡量电解质溶液导电能力的大小。向10mL 0.3 mol·L-1Ba(OH)2溶液滴入0.3 mol·L-1 NH4HSO4溶液,其电导率随滴入的NH4HSO4溶液体积的变化如图所示(忽略BaSO4溶解产生的离子)。下列说法不正确的是
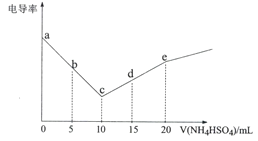
A.a→e的过程水的电离程度逐渐增大
B.b点:c(Ba2+) =0.1 moI.L-1
C.c点:c(NH4+)<c(OH-)
D.d点:c(SO42-)+c(H+)>c(OH-)+c(NH3H2O)
【答案】D
【解析】
ac段电导率一直下降,是因为氢氧化钡和硫酸氢铵反应生成硫酸钡沉淀和一水合氨,c点溶质为一水合氨,ce段电导率增加,是一水合氨和硫酸氢铵反应生成硫酸铵,溶液中的离子浓度增大。
A. a→e的过程为碱溶液中加入盐,水的电离程度逐渐增大,故正确;
B. b点c(Ba2+) = ![]() =0.1 moI.L-1,故正确;
=0.1 moI.L-1,故正确;
C. c点的溶质为一水合氨,一水合氨电离出铵根离子和氢氧根离子,水也能电离出氢氧根离子,所以有c(NH4+)<c(OH-),故正确;
D. d点溶液为等物质的量的一水合氨和硫酸铵,电荷守恒有①c(NH4+)+ c(H+)= 2c(SO42-)+ c(OH-),物料守恒有②c(NH4+)+ c(NH3H2O)=3 c(SO42-),②-①可得c(SO42-)+c(H+)=c(OH-)+c(NH3H2O),故错误。
故选D。


科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
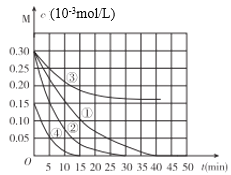
实验编号 | 温度°C | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验①④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于固定体积的密闭容器中进行的反应:A(g)+B(g)![]() C(g)+2D(g),不能说明在恒温下可逆反应已经达到平衡状态的是
C(g)+2D(g),不能说明在恒温下可逆反应已经达到平衡状态的是
①反应容器中压强不随时间变化而变化
②单位时间内生成A的物质的量与消耗D的物质的量之比为1:2
③混合气体的平均摩尔质量不随时间变化而变化
④反应混合气体的密度不随时间变化而变化
A. ②④ B. ③④ C. ①③ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知ROH固体溶于水放热,有关过程的能量变化如图(R=Na、K):
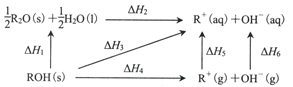
下列说法正确的是
A.△H1+△H2>0B.△H4(NaOH)>△H4(KOH)>0
C.△H6(NaOH>△H6(KOH)D.△H1+△H2+△H4+△H5+△H6=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为_________________。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数比为_____
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示)_________
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是________________________________________
(5)C、N两元素形成的化合物C3N4形成的原子晶体,结构类似金刚石,甚至硬度超过金刚石,其原因是____________________________
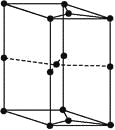
(6)如图为石墨晶胞结构示意图,该晶胞中含有碳原子的个数为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠![]() 是重要漂白剂.探究小组开展如下实验,回答下列问题:
是重要漂白剂.探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取![]() 晶体按如图装置进行制取。
晶体按如图装置进行制取。

已知:![]() 饱和溶液在低于
饱和溶液在低于![]() 时析出
时析出![]() ,高于
,高于![]() 时析出
时析出![]() ,高于
,高于![]() 时
时![]() 分解成
分解成![]() 和NaCl.
和NaCl.
(1)用![]() 双氧水配制
双氧水配制![]() 的
的![]() 溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______
溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______![]() 填仪器名称
填仪器名称![]() ;
;
(2)装置C的作用是______;
(3)装置B内生成的![]() 气体与装置D中混合溶液反应生成
气体与装置D中混合溶液反应生成![]() ,生成
,生成![]() 的反应方程式为______.
的反应方程式为______.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______;
(5)反应后,经以下步骤可从装置D的溶液获得![]() 晶体.请补充完整操作iii.
晶体.请补充完整操作iii.
![]() 蒸发结晶;
蒸发结晶;![]() 趁热过滤;iii.______;
趁热过滤;iii.______;![]() 低于
低于![]() 干燥,得到成品.
干燥,得到成品.
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的![]() 晶体中含少量
晶体中含少量![]() 。产生
。产生![]() 最可能的原因是______;
最可能的原因是______;
![]() 中有
中有![]() 气体产生,并有部分进入D装置内
气体产生,并有部分进入D装置内
![]() 中浓硫酸挥发进入D中与NaOH中和
中浓硫酸挥发进入D中与NaOH中和
![]() 中的硫酸钠进入到D装置内
中的硫酸钠进入到D装置内
(7)测定样品中![]() 的纯度。测定时进行如下实验:
的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:![]() ,将所得混合液稀释成100mL待测溶液。
,将所得混合液稀释成100mL待测溶液。
取![]() 待测溶液,加入淀粉溶液做指示剂,用c
待测溶液,加入淀粉溶液做指示剂,用c![]()
![]() 标准液滴定至终点,测得消耗标准溶液体积的平均值为V
标准液滴定至终点,测得消耗标准溶液体积的平均值为V![]() 已知:
已知:![]()
![]() 确认滴定终点的现象是______;
确认滴定终点的现象是______;
![]() 所称取的样品中
所称取的样品中![]() 的物质的量为______
的物质的量为______![]() 用含c、V的代数式表示
用含c、V的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,1molN2和3molH2催化反应后分子总数为2NA
B.100g98%的浓H2 SO4与过量的Cu反应后,电子转移数为NA
C.标准状况下,11.2L氧气和二氧化碳混合物中含氧原子数目为NA
D.1L1mol/LNa2CO3溶液中所含阴离子数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R 均是 1-18 号元素,原子序数依次增大。X 是所有元素中原子半径最小的元素,Y 原子最外层电子数是次外层电子数的 3 倍,Z、W、R 电子层数相同,R 与 Y 最外层电子数相同,Z、W 原子的核外电子数之和与 Y、R 原子的核外电子数之和相同。请回答下列问题:
(1)写出:W 的原子结构示意图_______,R 离子的电子式_________________。
(2)X、Y、Z 三种元素形成的化合物属于_______化合物(填“离子”或“共价”),其电子式为 _______。
(3)X 与 Y 元素可形成一种常用的消毒剂,其结构式为 _______。
(4)Y、Z、W、R 形成的简单离子半径由大到小顺序为_______。
(5)写出由 X、Y、Z、R 四种元素形成的化合物的电离方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比法是一种常用的化学思维,下列各项中类比结论正确的是
选项 | 已知 | 类比结论 |
A | 强碱弱酸盐 |
|
B |
|
|
C | 用惰性电极电解熔融的 | 用惰性电极电解熔融的 |
D |
|
|
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com