
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示.下列说法正确的是
与pH的关系如图所示.下列说法正确的是![]()
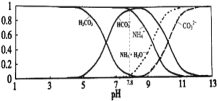
A.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
B.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
C.往该溶液中逐滴滴加氢氧化钠时![]() 和
和![]() 浓度逐渐减小
浓度逐渐减小
D.通过分析可知常温下![]()
科目:高中化学 来源: 题型:
【题目】某兴趣小组用废旧镀锌铁皮按下列流程制备七水硫酸锌(ZnSO4·7H2O)

相关信息如下:
①金属离子形成氢氧化物沉淀的pH,如图A所示。
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线如图B所示。
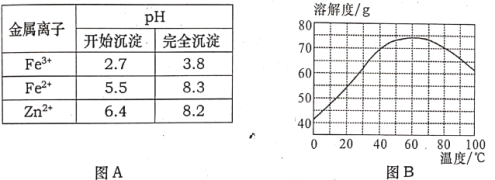
请回答:
(1)为提高镀锌铁皮中金属离子的浸出率,除了可适当增加硫酸的浓度,还可以采取的措施有:_______(任写一条)。
(2)步骤Ⅱ中需加入过量H2O2,请用离子方程式表示H2O2的作用________。
(3)步骤Ⅲ中调节pH范围为_______,调节pH宜选用的试剂为_______。
A.稀硫酸 B.氢氧化锌 C.氢氧化钠 D.氧化锌
(4)检验步骤Ⅲ所得滤液中是否含有Fe3+可采用的实验方法是_______。
(5)步骤Ⅳ需要用到下列所有操作:a.蒸发至溶液出现晶膜 b.在60℃蒸发溶剂 c.冷却至室温 d.在100℃蒸发溶剂 e.过滤
请给出上述操作的正确顺序______(操作可敢复使用)。
(6)步骤V中,某同学采用不同降温方式进行冷却结都,测得ZnSO4·7H2O颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均的较大晶粒,宜选择______方式进行冷却结晶。

A.快速降温 B.级慢降温 C.变速降温
(7)ZnSO4可用于制备金属锌。用锌和高铁酸钾制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,已知该电池的总反应是2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2。该电池正极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:
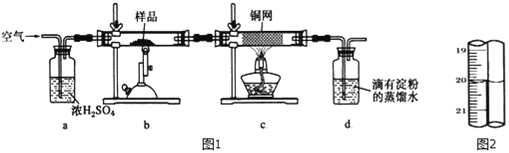
称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3 、FeO和SO2气体,实验后取d中溶液的1/5置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.10mL,末读数如图2所示.完成下列填空:
(1)装置c的作用是____________________________。
(2)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(3)滴定时,标准碘溶液所耗体积为_____mL;用化学方程式表示滴定的原理:________________________________________。
(4)计算该黄铜矿的纯度___________________。
(5)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3 、FeO、SiO2、Al2O3)可制备Fe2O3.
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液
所选试剂为_________;证明炉渣中含有FeO的实验现象为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是____。用O2表示0~1s内该反应的平均速率v=____。

(3)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列物质的分离提纯问题。
Ⅰ.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
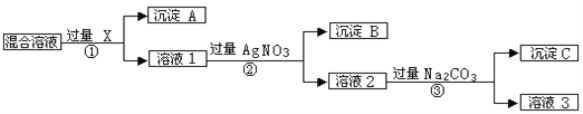
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X_______。
(2)证明AgNO3溶液加过量的实验方是_____________________________________________ 。(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________(填化学式),之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
Ⅱ.某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:_________________________________ (填编号字母)。
(2)从含碘的CCl4溶液中提取碘 和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有______ 处。
(3)进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。
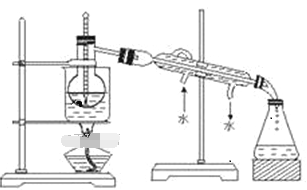
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。请回答下列问题:
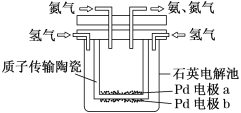
(1)此装置将______能转化为______能。
(2)Pd电极a为_____极(选填“正”、“负”、“阴”或“阳”),电极反应式为___。
(3)当制得6mol氨气时有____mol 质子从____极迁移到____极 (选填“a”或“b”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4;2NaCl+H2SO4![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S;Na2SO4+4C![]() Na2S+4CO↑
Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3;Na2S+CaCO3![]() Na2CO3+CaS
Na2CO3+CaS
下列说法正确的是( )
A.②③两步都是氧化还原反应
B.只有第②步是氧化还原反应
C.该方法对生产设备基本没有腐蚀
D.该方法对环境污染较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.能自发进行的反应一定能迅速发生
B.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为判断反应能否自发进行的判据
D.反应2N2(g)+O2(g)=2N2O(g) ΔH=+163 kJ·mol-1在高温下可以自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成抗过敏药孟鲁司特钠的重要中间体,其合成过程如下:
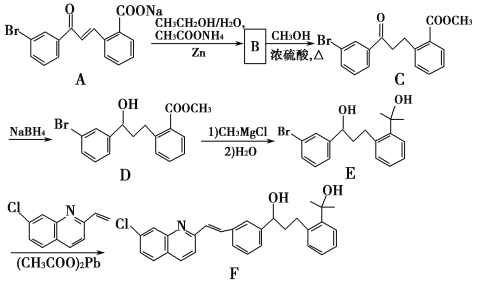
请回答下列问题:
(1)化合物B的分子式为C16H13O3Br,B的结构简式为_________。
(2)由C→D、E→F的反应类型依次为_________、_________。
(3)写出符合下列条件C的一种同分异构体的结构简式_________。
Ⅰ属于芳香族化合物,且分子中含有2个苯环
Ⅱ能够发生银镜反应
Ⅲ分子中有5种不同环境的氢原子。
(4)已知:RCl![]() RMgCl,写出以CH3CH2OH、
RMgCl,写出以CH3CH2OH、![]() 为原料制备
为原料制备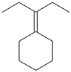 的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例见本题题干。____________
的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例见本题题干。____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com