
| 温度/℃ | 700 | 800 | 900 |
| 平衡常数 | 0.1 | X | 1 |
| A. | △H>0 | |
| B. | 平衡时,c(B)为0.6 mol•L-1 | |
| C. | 800℃时平衡常数X=4/9 | |
| D. | 900℃该反应达到平衡状态时,A的物质的量为0.5 mol |
分析 A.由表数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动,则正反应为吸热反应;
B.根据△c=v×△t计算△c(B),B的平衡浓度=B的起始浓度-△c(B);
C.平衡时△c(B)=0.04mol/(L•s)×5s=0.2mol/L,则:
A(g)+B(g)?C(g)+D(g)
起始浓度(mol/L):0.5 0.5 0 0
变化浓度(mol/L):0.2 0.2 0.2 0.2
平衡浓度(mol/L):0.3 0.3 0.2 0.2
代入平衡常数K=$\frac{c(C)×c(D)}{c(A)×c(B)}$计算;
D.A、B的起始物质的量均为1mol,由900℃平衡常数K=$\frac{c(C)×c(D)}{c(A)×c(B)}$=1,可知平衡时n(A)=n(B)=n(C)=n(D).
解答 解:A.由表数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动,则正反应为吸热反应,故△H>0,故A正确;
B.△c(B)=0.04mol/(L•s)×5s=0.2mol/L,B的平衡浓度=$\frac{1mol}{2L}$-0.2mol/L=0.3mol/L,故B错误;
C.平衡时△c(B)=0.04mol/(L•s)×5s=0.2mol/L,则:
A(g)+B(g)?C(g)+D(g)
起始浓度(mol/L):0.5 0.5 0 0
变化浓度(mol/L):0.2 0.2 0.2 0.2
平衡浓度(mol/L):0.3 0.3 0.2 0.2
900℃平衡常数K=$\frac{c(C)×c(D)}{c(A)×c(B)}$=$\frac{0.2×0.2}{0.3×0.3}$=$\frac{4}{9}$,故C正确;
D.A、B的起始物质的量均为1mol,由900℃平衡常数K=$\frac{c(C)×c(D)}{c(A)×c(B)}$=1,可知平衡时n(A)=n(B)=n(C)=n(D),故平衡时A的物质的量为0.5 mol,故D正确,
故选:B.
点评 本题考查化学平衡计算与影响因素,涉及平衡常数计算及应用,注意对知识的理解与灵活应用.


科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
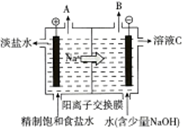 电解饱和食盐水的原理如图所示.
电解饱和食盐水的原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当它们等物质的量时,质量比就为11:7 | |
| B. | 当它们等质量时,碳原子个数比为1:1 | |
| C. | 当它们同温同压同质量时,体积之比为7:11 | |
| D. | 当它们同温同压同体积时,电子总数之比为7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2A、NaHA、H2A的溶液中所存在的阴离子种类不同 | |
| B. | 在NaHA溶液离子浓度大小顺序为:c(Na+)>c(A-)>c(HA-)>c(OH-)>c(H+) | |
| C. | 相同物质的量浓度的Na2A和NaHA溶液,前者pH大于后者 | |
| D. | HA-的水解方程式为:HA-+H2O?A-+H3O- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com