
 $\stackrel{△}{→}$
$\stackrel{△}{→}$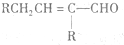 兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸
兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸 合成兔耳草醛的路线如下:
合成兔耳草醛的路线如下:
 、
、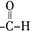 (写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热
(写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热 .
. 、
、 .
. 分析 由题给信息反应原理可知:枯茗醛和丙醛反应生成的A为: ;B能与氢气在Ni为催化剂条件下发生加成反应生成C、C催化氧化生成兔耳草醛(C13H18O),则C中含有只含有1个羟基,C到兔耳草醛为醇催化氧化生成醛,所以A发生消去反应生成B,B的结构简式为;
;B能与氢气在Ni为催化剂条件下发生加成反应生成C、C催化氧化生成兔耳草醛(C13H18O),则C中含有只含有1个羟基,C到兔耳草醛为醇催化氧化生成醛,所以A发生消去反应生成B,B的结构简式为; ;B与氢气加成生成C,则C为:
;B与氢气加成生成C,则C为: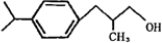 ;兔耳草醛为:
;兔耳草醛为: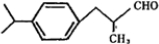 ,以此进行解答.
,以此进行解答.
解答 解:由题给信息反应原理可知:枯茗醛和丙醛反应生成的A为: ;B能与氢气在Ni为催化剂条件下发生加成反应生成C、C催化氧化生成兔耳草醛(C13H18O),则C中含有只含有1个羟基,C到兔耳草醛为醇催化氧化生成醛,所以A发生消去反应生成B,B的结构简式为;
;B能与氢气在Ni为催化剂条件下发生加成反应生成C、C催化氧化生成兔耳草醛(C13H18O),则C中含有只含有1个羟基,C到兔耳草醛为醇催化氧化生成醛,所以A发生消去反应生成B,B的结构简式为; ;B与氢气加成生成C,则C为:
;B与氢气加成生成C,则C为: ;兔耳草醛为:
;兔耳草醛为: ,
,
(1)枯茗醛的结构简式为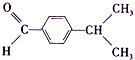 ,其分子中含有5种等效H原子,所以其核磁共振氢谱中出现5种峰;A到B的反应为
,其分子中含有5种等效H原子,所以其核磁共振氢谱中出现5种峰;A到B的反应为 发生消去反应生成
发生消去反应生成 ,
,
故答案为:5;消去反应;
(2)B的结构简式为: ,其分子中含有的官能团为碳碳双键和醛基,其结构式分别为:
,其分子中含有的官能团为碳碳双键和醛基,其结构式分别为: 、
、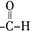 ;
;
B中含氧官能团为醛基,检验醛基的方法为:配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热,
故答案为: 、
、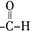 ;配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热;
;配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热;
(3)C催化氧化生成兔耳草醛,反应的化学方程式为: ,
,
故答案为: ;
;
(4)A为 ;①苯环上有两个取代基,其中一个取代基为-CH(CH3)2,②能发生水解反应,水解产物之一能与FeCl3溶液发生显色反应,说明有机物分子中含有酯基,且水解产物中含有酚羟基,则满足条件的有机物在苯环上含有的取代基有两种情况:①-CH(CH3)2、-OOCCH(CH3)2②-CH(CH3)2、-OOCCH2CH2CH3,满足取代基在苯环上都存在邻、间、对三种同分异构体,所以总共有6种满足条件的同分异构体,如:
;①苯环上有两个取代基,其中一个取代基为-CH(CH3)2,②能发生水解反应,水解产物之一能与FeCl3溶液发生显色反应,说明有机物分子中含有酯基,且水解产物中含有酚羟基,则满足条件的有机物在苯环上含有的取代基有两种情况:①-CH(CH3)2、-OOCCH(CH3)2②-CH(CH3)2、-OOCCH2CH2CH3,满足取代基在苯环上都存在邻、间、对三种同分异构体,所以总共有6种满足条件的同分异构体,如: 、
、 ,
,
故答案为: ;
; .
.
点评 本题有机合成,侧重于有机物的结构和官能团的性质的考查,为高考常见题型,题目难度中等,注意题给信息以及官能团的性质,为解答该题的关键,(4)为难点,需要明确题中限制条件的含义及同分异构体的书写原则.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 电负性 | 熔沸点 | 稳定性 | 酸性 |
| O>N | NH3>PH3 | Fe2+< Fe3+ | H3PO4<HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ | |
| B. | 硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3•H2O+H2O | |
| C. | 碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3•H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钙和铁粉常用作食品干燥剂 | |
| B. | 二氧化硫有毒所以不能用作食品防腐剂 | |
| C. | 碳酸钡不溶于水因此在医疗上用作钡餐 | |
| D. | 当光束通过稀豆浆时能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:Y>Z>X | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | X与R的核电荷数相差24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Ka(HCN)<Ka(CH3COOH),当物质的量浓度相同时,CH3COOH中水电离出c(H+)大于HCN中水电离出的c(H+) | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 向2.0 mL浓度均为0.1 mol•L-1 的KCl、KI混合溶液中滴加1~2滴0.01 mol•L-1 AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大 | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com