
| A. | 在一定条件下,苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| B. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| C. | 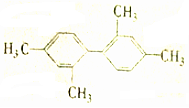 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 聚合物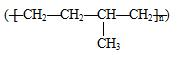 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
分析 A.苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应,苯环的H原子被其它原子或原子团替代;
B.己烷有五种同分异构体;
C.含有苯环,与苯环直接相连的原子在同一个平面上;
D.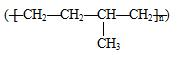 可由CH3CH=CH2和CH2=CH2发生加聚反应生成.
可由CH3CH=CH2和CH2=CH2发生加聚反应生成.
解答 解:A.苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应,苯环的H原子被其它原子或原子团替代,为取代反应,故A正确;
B.己烷有五种同分异构体,其碳链结构分别为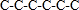 、
、 、
、 、
、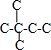 、
、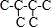 ,己烷同分异构体为不同物质,所以其熔沸点不同,且含有支链越多其熔沸点越低,故B错误;
,己烷同分异构体为不同物质,所以其熔沸点不同,且含有支链越多其熔沸点越低,故B错误;
C.甲基至少有1个碳原子与苯环共面,苯环上所有的原子共面以及苯环上处于对称位置上的4个原子共线,所以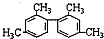 分子中至少有11个碳原子处于同一平面,故C正确;
分子中至少有11个碳原子处于同一平面,故C正确;
D.由结构简式可知,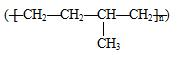 可由CH3CH=CH2和CH2=CH2发生加聚反应生成,故D正确.
可由CH3CH=CH2和CH2=CH2发生加聚反应生成,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机物的组成及有机反应为解答的关键,侧重分析与应用能力的考查,注意己烷的同分异构体判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液、NaOH溶液、碱石灰 | B. | 浓氨水、NaOH固体、浓硫酸 | ||
| C. | NH4Cl固体、消石灰、碱石灰 | D. | 浓NaOH溶液、NH4C固体、浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①分离出BaSO4浊液中的BaSO4 | |
| B. | ②除去CO2中少量HCl气体 | |
| C. | ③配制一定物质的量浓度溶液时转移溶液 | |
| D. | ④制取一定量的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
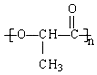 一次性使用的聚苯乙烯材料带来的“白色污染”就是一种较为严重的污染现象,最近研制的一种新型材料 能代替聚苯乙烯.它是由乳酸聚合而成的.这种材料可以在乳酸菌作用下完全降解.下列关于聚乳酸的说法正确的是( )
一次性使用的聚苯乙烯材料带来的“白色污染”就是一种较为严重的污染现象,最近研制的一种新型材料 能代替聚苯乙烯.它是由乳酸聚合而成的.这种材料可以在乳酸菌作用下完全降解.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | B. | 聚乳酸的聚合方式与聚苯乙烯相似 | ||
| C. | 聚乳酸的单体为CH3CH(OH)COOH | D. | 聚乳酸的链节为n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2 | B. | △H1<△H2 | C. | △H1﹦△H2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
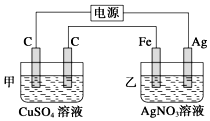 观察如图所示装置,在通电一段时间后,铁电极的质量增加了5.4g.
观察如图所示装置,在通电一段时间后,铁电极的质量增加了5.4g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②⑤⑦ | C. | ②④⑦ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
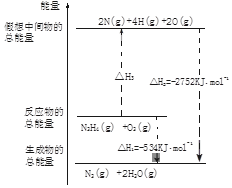 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.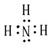 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com