
分析 (1)根据电离和水解的定义来分析解答;
(2)当向其中加入硫酸铜溶液时,生成了CuS沉淀,促进HS-的电离,HS-浓度减小,水解程度减小,溶液中H+的浓度增大;
(3)水的电离是吸热反应,升高温度促进其电离;
(4)根据溶液的电中性计算H+浓度.
解答 解:(1)根据电离和水解定义知,b是电离平衡,a是水解平衡,故选:b;a;
(2)向其中加入硫酸铜溶液时,生成了CuS沉淀,S2-浓度减小,促进HS-的电离,电离平衡向右移动,溶液中H+的浓度增大,HS-浓度减小,水解平衡向左移动,水解程度减小,
故答案为:正向;逆向;
(3)水的电离是吸热反应,升高温度促进水电离,所以水的离子积常数增大,故答案为:大;
(4)在0.1mol•L-1硫酸铜溶液中加入适量NaHS固体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42-)不变,为0.1mol•L-1,由电荷守恒可知c(H+)为0.2mol•L-1,
故答案为:0.2.
点评 本题考查了弱电解质的电离及其盐类水解,明确弱电解质电离及水解特点是解本题关键,注意浓度对平衡移动的影响,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 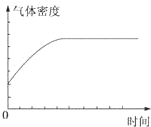 | B. | 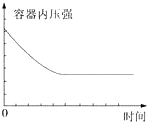 | ||
| C. | 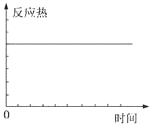 | D. | 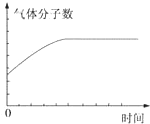 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
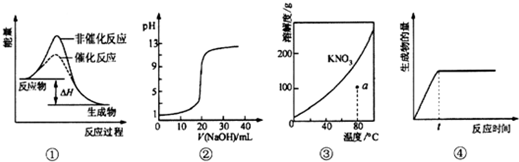
| A. | ①表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | ②表示0.1 mo1•L-1NaOH溶液滴定20 mL 0.1 mo1•L-1HCl溶液所得到的滴定曲线 | |
| C. | ③表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| D. | 某可逆反应生成物的量随反应时间关系如图④所示,在t时反应物转化率达到最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | KAl(SO4)2 12H2O | C. | C2H5OH | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液稀释至10倍后pH=4 | |
| C. | 0.2 mol/L的盐酸与0.1 mol/L的盐酸等体积水混合后pH=1.5 | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
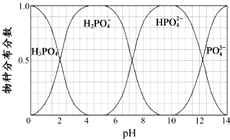 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②⑤ | C. | ①③⑤⑥ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com