
有A、B、C、D、E五种短周期元素,其原子序数依次增大。A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题:

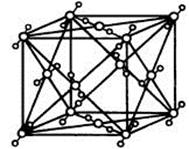
(1)C、D两元素形成的化合物的晶体类型是 。BC2的结构式 ;在一定温度下,用x射线衍射法测BC2晶胞(晶体中最小的重复单位)边长: a=5.72×10-8cm,该温度下BC2的密度为
(2)若F是D的同主族下一周期元素,则F的电子排布式是: ,
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n。在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如右图所示,试填空。
①含1molA2C的该晶体中有_____mol“氢键”。
②若G是C的同主族下一周期元素,请比较A2C与A2G沸点的高低______________。(填分子式)
(9分)(1)离子晶体(1分) O="C=O" (1分)1.56g/cm3(2分)(2)1S22S22P63S23P64S1(1分)
(3)Al(OH)3+OH-=AlO2-+2H2O(2分) (4)① 2 (1分)②H2O > H2S(1分)
【解析】
试题分析:A原子的电子层数与它的核外电子总数相同,则A应该是氢元素。B原子核外最外层电子数是次外层电子数的2倍,则B是碳元素。C元素的原子基态时2p能级是2s能级上的电子数的2倍,所以C是氧元素。D是该周期中原子半径最大的主族元素,则D是钠元素。E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575,这说明E元素的第四电离能远大于第三电离能,则E是第ⅢA族元素,即是铝元素。
(1)C、D两元素形成的化合物是氧化钠或过氧化钠,其晶体类型都是离子晶体。BC2的结构式O=C=O。根据CO2都晶体结构可知,该晶胞中含有4个CO2分子,则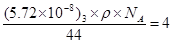 ,解得ρ=1.56g/cm3。
,解得ρ=1.56g/cm3。
(2)若F是D的同主族下一周期元素,则F是K元素,所以根据构造原理可知,其电子排布式是1S22S22P63S23P64S1。
(3)氢氧化铝是两性氢氧化物,则该反应的方程式是Al(OH)3+OH-=AlO2-+2H2O。
(4)①根据结构示意图可知,平均1个水分子形成2个氢键,所以含1molA2C的该晶体中有2mol“氢键”。
②若G是C的同主族下一周期元素,则G是S元素。由于水分子间存在氢键,所以水的沸点高于H2S的沸点。
考点:考查晶体类型、结构式、核外电子排布、氢键以及物质沸点高低比较和晶体的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,综合性强,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和空间想象能力。该类试题主要是以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:






查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
32 16 |
32 16 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:






查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com