
【题目】铁、铜及其化合物在工农业生产中应用广泛。
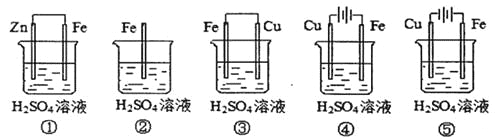
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为_______。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是____________(用序号填写)。
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)![]() H=-1118 kJ·mol-1
H=-1118 kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)![]() H=-1675.7 kJ·mol-1
H=-1675.7 kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为______________。
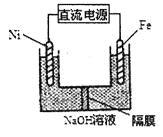
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式______。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是______________。
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是____________。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为____。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]=______。
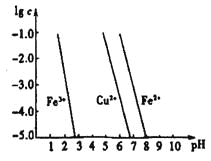
已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度![]() 10-5mol·L-1时,可认为沉淀完全)。
10-5mol·L-1时,可认为沉淀完全)。
【答案】2Fe + O2+ 2H2O = 2Fe(OH)2 ⑤③②①④ 8Al(s)+3Fe3O4(s)=4Al2O3(s)+9Fe(s) △H= 3349.8 kJ·mol-1 Fe + 8OH--6e-= FeO42-+ 4H2O Na2FeO4具有强氧化性,能起到杀菌、消毒作用;高价的铁被还原成的Fe3+水解生成Fe(OH)3胶体,能吸附水中杂质。 2Fe3+ + Cu = 2Fe2++Cu2+ Cu2+、Fe2+ 1.0×10-17(mol·L-1)3
【解析】
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为: 2Fe + O2+ 2H2O = 2Fe(OH)2;①Zn为负极,Fe为正极,Fe受到保护;②Fe与硫酸发生置换反应,被氧化变为Fe2+,比①腐蚀的快;③构成Fe-Cu原电池,Fe作负极,首先被腐蚀,腐蚀速率③>②;④形成电解池,Fe为阴极,被保护,只要存在外加电源,Fe就不会被腐蚀,所以腐蚀速率④<①;⑤构成电解池。由于Fe为阳极,被氧化,发生氧化反应,腐蚀速率比③快。所以铁腐蚀的速率由快到慢的顺序是⑤③②①④;
(2)②×4-①×3,整理可得:8Al(s)+3Fe3O4(s)=4Al2O3(s)+9Fe(s) △H= 3349.8 kJ·mol-1;(3)Na2FeO4具有强氧化性,其电解制法如图所示,则在阳极,Fe失去电子,被氧化,与溶液中的OH-结合反应,阳极的电极反应式是Fe + 8OH--6e-= FeO42-+ 4H2O;Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是Na2FeO4中的Fe化合价为+6价,具有强氧化性,能起到杀菌、消毒作用;高价的铁被还原成的Fe3+发生水解反应生成Fe(OH)3胶体,表面积大,吸附能力强,能吸附水中杂质,使之形成沉淀,从水中分离出去,从而使水得到净化。(4)工业上常用FeCl3溶液腐蚀印刷线路板,Fe3+将Cu单质氧化为Cu2+,Fe3+被还原变为Fe2+,根据电子守恒、电荷守恒及原子守恒,可得发生反应的离子方程式是2Fe3+ + Cu = 2Fe2++Cu2+;根据图像可知,在溶液的pH接近3而小于3时,Fe3+已经沉淀完全。所以在溶液的pH=5.6时,溶液中存在的金属阳离子为Cu2+、Fe2+;Fe(OH)2的溶度积Ksp[Fe(OH)2]=c(Fe2+)c2(OH-)=10-5×(10-14÷10-8)21.0×10-17(mol·L-1)3。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:
【题目】NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为______________________________电解后的溶液PH____________7(填大于、小于、等于);其原因是_________________________________________(用离子方程式表示)
(2)KAl(SO4)2溶液中质子守恒等式为_______________________________________
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。
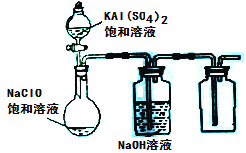
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。此时反应的离子方程式为__________________________________。
②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体。写出在光照射下混合液中反应的化学方程式是________________________。
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4·FeSO4)溶液,其他不变。打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液。观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生。此时烧瓶中发生的氧化还原反应的离子方程式为______________________。
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为_______________(忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2,硫氰(SCN)2等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为: Cl-<Br-<CN-<SCN-<I-,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是
A.4HCN(浓)+MnO2![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
B.(CN)2+H2O=2H++CN-+CNO-
C.(CN)2+2OH-=CN-+CNO-+H2O
D.(CN)2+2SCN-=2CN-+(SCN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应均可生成![]() 。下列有关说法正确的是
。下列有关说法正确的是![]()
![]() 二氧化碳分解生成氧气:
二氧化碳分解生成氧气:![]() ;
;![]()
![]() 过氧化氢分解生成氧气:
过氧化氢分解生成氧气:![]() ;
;![]()
![]() 光照条件下,催化分解水蒸气生成氧气:
光照条件下,催化分解水蒸气生成氧气:![]() ;
;![]() 。
。
A.反应![]() 使用催化剂,能降低该反应的活化能
使用催化剂,能降低该反应的活化能
B.反应![]() 为吸热反应
为吸热反应
C.反应![]() 将化学能转化为光能
将化学能转化为光能
D.反应![]() ;
;![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化, 产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
反应II:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4kJ·mol-1
2CH3OH(g) △H2=+23.4kJ·mol-1
反应III:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_____________kJ·mol-1
(2)恒温恒容条件下,在密闭容器中通人等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加人等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.6 | 1.6 | 0.8 |
此时![]() ___
___![]() (填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
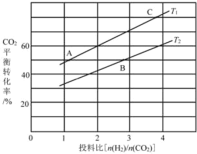
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=____。
(5)恒压下将CO2和氏按体积比1 :3混合,在 不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性=![]() ×100%
×100%
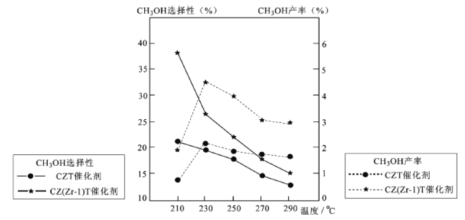
②在上述条件下合成甲醇的工业条件是_________。
A. 230℃ B. 210℃ C.催化剂 CZT D.催化剂 CZ(Zr-1)T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
下列说法错误的是( )
A.CH3OH转变成H2的反应不一定要吸收能量
B.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ
C.反应①中的能量变化如图所示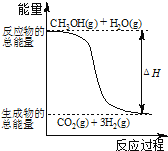
D.根据反应①和②推知:H2(g)+1/2O2(g)=H2O(g) ΔH=-241.9kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔生理学或医学奖的一半授予我国药物化学家屠呦呦,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素。以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图)。下列说法正确的是

A.异胡薄荷醇的分子式为C10H17O
B.异胡薄荷醇在NaOH醇溶液中可发生消去反应
C.青蒿素分子中含有7个手性碳原子
D.青蒿素在热的酸、碱溶液中均可稳定存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com