
【题目】实验室里需要配制480 mL 0.10 mol·L-1的硫酸铜溶液,实验操作步骤有:
A.在天平上称取所需硫酸铜固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并恢复至室温
B.把所得的溶液小心地转移到容量瓶中
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡
E.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)___________________。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒、药匙,还缺少的仪器是______、___________。
(3)实验过程中需用天平量取___________g无水硫酸铜。
(4)下列情况会使所配溶液浓度偏高的是(填序号)_________________。
a.某同学观察液面的情况如图所示
b.没进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
【答案】ABDCE 500mL容量瓶 胶头滴管 8.0 ad
【解析】
(1)根据一定物质的量浓度溶液的配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等步骤来排序;
(2)根据配制溶液的各个步骤使用的仪器分析判断;
(3)先选择使用的容量瓶的规格,根据溶液的均一性,由n=cV计算溶质的物质的量,再根据m=nM计算质量;
(4)根据物质的量浓度c=![]() 分析误差。
分析误差。
(1)一定物质的量浓度溶液的配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶贴标签,故操作顺序为ABDCE;
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒、药匙,还缺少的仪器是500mL容量瓶和胶头滴管;
(3)配制480mL0.10mol/L的硫酸铜溶液,没有480mL规格的容量瓶,根据选择仪器的标准是大而近的原则,要使用500mL容量瓶,溶液的浓度相同,则需要溶质的物质的量n=cV=0.10mol/L×0.5L=0.050mol,则需要称量无水硫酸铜的质量m=nM=0.05mol×160g/mol=8.0g;
(4)若所配溶液浓度偏高,根据c=![]() 可能是溶质的质量偏大,也可能是溶液的体积偏小。
可能是溶质的质量偏大,也可能是溶液的体积偏小。
a.俯视读数,使溶液的体积V偏小,则溶液的浓度偏大,a符合题意;
b.没进行上述的操作步骤D,则溶质的物质的量偏少,导致溶液的浓度偏低,b不符合题意;
c.加蒸馏水时,不慎超过了刻度线,溶液的体积偏大,导致配制的溶液浓度偏低,c不符合题意;
d.砝码上沾有杂质,使溶质的质量偏大,n就偏大,最终导致溶液的浓度偏高,d符合题意;
e.容量瓶使用前内壁沾有水珠,不影响溶质的物质的量和溶液的体积,因此对配制溶液的浓度无影响,e不符合题意;
故合理选项是ad。


科目:高中化学 来源: 题型:
【题目】25℃时用![]() 溶液沉淀
溶液沉淀![]() 、
、![]() 两种金属离子
两种金属离子![]() ,所需
,所需![]() 最低浓度的对数值
最低浓度的对数值![]() 与
与![]() 的关系如下图。下列说法中错误的是( )
的关系如下图。下列说法中错误的是( )
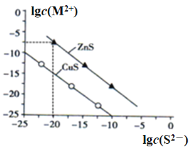
A. ![]() 时,
时,![]() 比
比![]() 的
的![]() 小
小
B. ![]() 时,
时,![]() 约为
约为![]()
C. ![]() 溶液中:
溶液中:![]()
D. 向![]() 浓度为
浓度为![]() 的废水中加入
的废水中加入![]() 粉末,会有
粉末,会有![]() 沉淀析出
沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,用途广泛。几位同学进行了如下实验以检验摩尔盐溶液中的NH4+、Fe2+、SO42-。
完成下列填空:
(1)甲同学向试样溶液中加入足量的Ba(OH)2溶液,微热,逸出可使_______试纸变蓝的气体以检验NH4+离子,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有_________色,用足量_______溶液处理沉淀物,沉淀部分溶解以检验Fe2+、SO42-;
(2)乙同学提出检验Fe2+的方法:先向试样溶液中滴加KSCN,溶液呈无色,再加___________试剂,溶液呈血红色则有Fe2+。但实际操作中,乙同学向试样溶液中加入KSCN后,发现溶液变成浅红色,原因是________________;
丙同学欲测定某摩尔盐样品中Fe2+的含量。他称取0.400g该样品,溶于水,加入适量稀硫酸后,用0.0200mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL。
反应的离子方程式为:5Fe2++MnO4-+8H+→Mn2++5Fe3++4H2O。
(3)滴定终点的现象是_______________________,样品中Fe2+的百分含量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超细氧化铝是一种重要的功能陶瓷原料。
Ⅰ、(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式为________________________________________________。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程中须称量NH4Al(SO4)2·12H2O固体_________g;
(3)在0.1 mol·L-1 NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见如图:
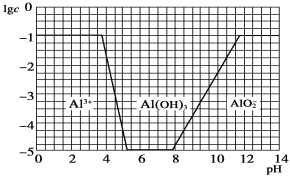
用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有_______________________、_______________________。
Ⅱ、从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程:
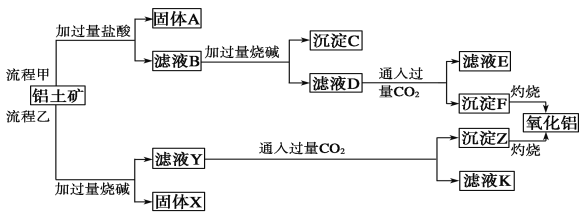
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_________________________。
(2)流程乙向滤液Y中通入足量CO2的离子方程式为_____________________。
(3)滤液E、K中溶质的主要成分是__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于mg H2和ng He的下列说法正确的是( )
A.同温同压下,H2和He的体积比为m:2n
B.同温同压下,若m=n,则H2与He的物质的量比为2:1
C.体积相同时,He的质量一定大于H2
D.若二者的物质的量相等,其体积也相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( B )
nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( B )
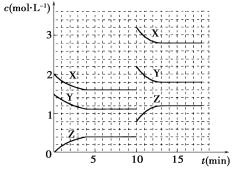
A. 反应方程式中n=1
B. 10 min时,曲线发生变化的原因是升高温度
C. 10 min时,曲线发生变化的原因是增大压强
D. 0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Ca(OH)2、NaAlO2、NaOH配成100.0mL混合溶液,向该溶液中通入足量CO2,生成沉淀的物质的量n(沉淀),与通入CO2的体积(标准状况下)V(CO2)的关系,如图所示,下列说法中正确的是( )
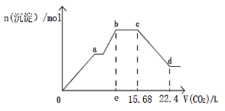
A. 混合溶液中c(NaOH)+c(NaAlO2)=0.4mol/L
B. e点的值为11.2
C. cd段表示Al(OH)3沉淀溶解
D. bc段的化学反应方程式为:NaOH+CO2=NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有NaCl、NaHCO3和NH4Cl中的一种或多种。下列根据实验事实得出的结论正确的是
A. 取一定量固体,在空气中充分加热,有白色物质残留,则原白色固体中含NaCl
B. 取一定量固体,加水溶解,向溶液中加入少量NaOH溶液,再滴加AgNO3溶液,有白色沉淀生成,则该白色沉淀是AgCl
C. 取一定量固体,加水溶解,向溶液中滴加足量NaOH溶液,加热,将得到气体直接通入足量浓硫酸,浓硫酸增重3.40 g,则原白色固体中含NH4Cl 10.7 g
D. 取一定量固体,加水溶解,向溶液中滴加足量Ba(OH)2溶液,有白色沉淀生成,将沉淀过滤、洗涤、干燥,得到沉淀质量为3.94 g,则原白色固体中含NaHCO3 1.68 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再改变
B. 氯化氢的转化率不再改变
C. 断开4 mol H—Cl键的同时生成4 mol H—O键
D. n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com