
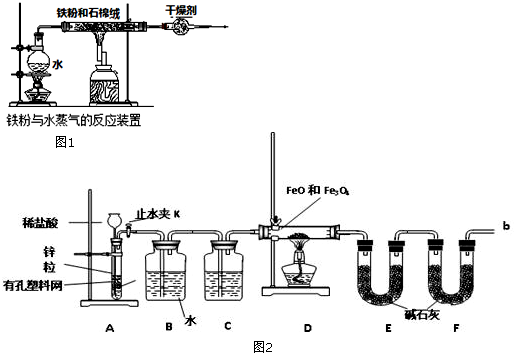
分析 实验一:(1)铁能与空气中的氧气发生反应,先加热酒精灯利用生成的水蒸气排除装置中的空气;装置中石棉绒可以增大水蒸气与铁粉的接触面积;
(2)分析两个反应可知产生四氧化三铁需要的铁少,因此可依据3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2 ,由氢气的质量求出需要铁的质量;
实验二:利用装置A制备氢气,加入药品反应可以随时进行随时停止,通过装置B除去挥发出的氯化氢气体,通过装置C中的浓硫酸干燥氢气,通过装置D还原铁的氧化物得到金属铁和水蒸气,通过装置E吸收生成的水蒸气,最后连接装置F是为了避免空气中的二氧化碳和水蒸气进入装置E影响测定结果,
(1)根据检验气密性的方法进行分析解答;
(2)根据锌和盐酸反应产生氯化锌和氢气写出反应的方程式;
(3)根据氢气容易发生爆炸分析使用注意事项;
(4)根据产生的氢气会混有杂质,要进行除杂、干燥分析装置的作用;
(5)根据碱石灰会吸收空气中的二氧化碳和水蒸气导致E装置质量增加大,会使测定的水多,影响实验的沉淀分析;
解答 解:实验一:(1)铁能与空气中的氧气发生反应,因此为了排除氧气的干扰,先加热酒精灯利用生成的水蒸气排除装置中的空气;装置中石棉绒可以增大水蒸气与铁粉的接触面积,
故答案为:酒精灯;先产生水蒸气,排尽空气;增大铁粉与水蒸气的接触面积;
(2)设生成0.2g氢气至少需要铁的质量为x
3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
168 8
x 0.2g
=x=4.2g
故答案为:4.2;
实验二(1)检查A装置气密性的方法:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,形成的液柱不下降,即液面高度差不变,则气密性良好;
故答案为:不变
(2)锌和盐酸反应产生氯化锌和氢气;
故反应的方程式为:Zn+2HCl=ZnCl2+H2↑
(3)因为氢气在点燃时容易发生爆炸,验纯为了安全,在点燃酒精灯之前,在F装置出口b处必须验纯;
故答案为:验纯;
(4)产生的氢气会混有氯化氢和水蒸气,因此要先通过水除去氯化氢,再通过浓硫酸除去水蒸气;
故答案为:浓硫酸;除去HCl气体;
(5)碱石灰会吸收空气中的二氧化碳和水蒸气导致E装置质量增加大,会使测定生成的水多,使测定的结果偏大;
故答案为:防止空气中的二氧化碳和水被E吸收;偏大;
点评 本题属于信息题的考查,考查了物质性质的探究,依据题目的信息及已有的知识进行分析计算,难度中等,能够考查学生的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 制备收集CO2:连接b→d→e | B. | 制备收集H2:连接b→c→g | ||
| C. | 制备收集NH3:连接b→d→e→c | D. | 制备收集Cl2:连接a→f→c→e→d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 | |
| B. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | H2SO4 | C. | NaOH | D. | Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu最外层电子数相同 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U化学性质完全相同 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水,浓H2SO4 | B. | 酸性KMnO4溶液,浓H2SO4 | ||
| C. | 溴水,烧碱溶液,浓硫酸 | D. | 浓H2SO4,酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验时酸或碱溅到眼中,应立即用水冲洗,并不断眨眼,不能用手搓揉眼睛 | |
| B. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氨水后滴加KSCN溶液 | |
| C. | 证明钢铁吸收氧腐蚀的方法是:在镀锌铁皮上滴1~3滴含酚酞的饱和食盐水,静置1~2min,观察现象 | |
| D. | 因为氧化铁是一种碱性氧化物,所以常用作红色油漆和涂料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com