
| A. | pH=a的醋酸溶液稀释10倍后,其pH=b,则b=a+1 | |
| B. | 浓度相同的①NH4Cl;②CH3COONH4;③NH4HSO4三种溶液的c(NH4+):①>③>② | |
| C. | 浓度相同的氨水与盐酸等体积混合:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 将amol•L-1CH3COOH与bmol•L-1NaOH溶液等体积混合,测得溶液pH为7,则a>b |
分析 A.醋酸为弱电解质,加水稀释,电离平衡正向移动,溶液的pH变化小于1;
B.醋酸根离子促进了铵根离子的水解,硫酸氢铵中的氢离子抑制了铵根离子的水解;
C.混合液的溶质为氯化铵,铵根离子部分水解,溶液显示酸性,则c(Cl-)>c(NH4+);
D.若a=b,反应生成醋酸钠溶液显示碱性,若要使混合液的pH=7,则醋酸需要稍过量.
解答 解:A.醋酸为弱电解质,加水稀释后促进了醋酸的电离,电离平衡正向移动,故将pH=a的醋酸溶液稀释10倍后,溶液的pH=b,则b<(a+1),故A错误;
B.浓度相同的①NH4Cl;②CH3COONH4;③NH4HSO4三种溶液中,由于醋酸根离子促进了铵根离子的水解、氢离子抑制了铵根离子的水解,则三种溶液中的c(NH4+)大小为:③>①>②,故B错误;
C.浓度相同的氨水与盐酸等体积混合,反应后溶质为氯化铵,铵根离子部分水解,溶液显示酸性,则c(Cl-)>c(NH4+)、c(H+)>c(OH-),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D.amol•L-1CH3COOH与bmol•L-1NaOH溶液等体积混合,测得溶液pH=7,由于a=b时混合液为碱性,则pH=7时醋酸应该过量,即a>b,故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、弱电解质的电离及其影响为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
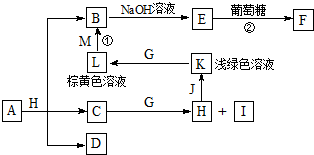 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.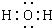 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molA可与2molNaOH完全反应 | |
| B. | 如果条件合适,B可能发生加聚反应,也可能发生缩聚反应 | |
| C. | 有机物C的所有同分异构体中不可有芳香族化合物存在 | |
| D. | D 与Br2的CCl4溶液反应,最多有4种生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
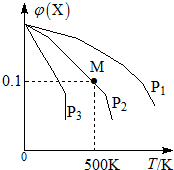 某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )| A. | 升高温度,该反应平衡常数K减小 | B. | 压强大小有P3>P2>P1 | ||
| C. | 平衡后加入高效催化剂使Mr增大 | D. | 在该条件下M点X平衡转化率为$\frac{9}{11}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,pH=6的纯水中,c(OH-)与c(H+)之比 | |
| B. | 常温下,pH=1的HF溶液与0.1mol•L-1的盐酸中c(H+)之比 | |
| C. | 常温下,pH=7的CH3COOH与CH3COONa的混合溶液中,c(CH3COO-)与c(Na+)之比 | |
| D. | 常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
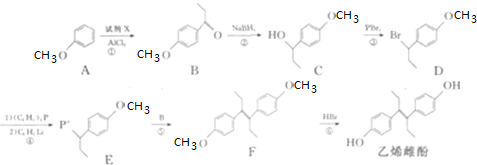
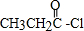 ;
;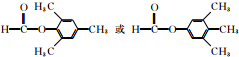 (任写一种).
(任写一种).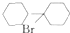 可由
可由 经五步反应合成:
经五步反应合成: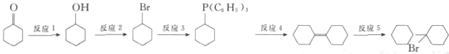
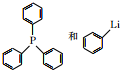 (写结构简式);
(写结构简式);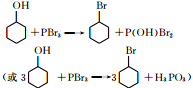 ;
;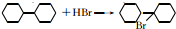 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L乙醇完全燃烧所生成的气态产物的分子数为NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5摩尔硅中含有的化学键数目为NA | |
| D. | 1 mo CH3+所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验. 序号 | 碳酸钙 | C(HCl)/ mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com