
科目:高中化学 来源:福建省月考题 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2 
查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:0103 期末题 题型:填空题
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 CO2+H2。已知部分物质燃烧的热化学方程式如下:
CO2+H2。已知部分物质燃烧的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源:同步题 题型:单选题
 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是 
查看答案和解析>>
科目:高中化学 来源:0108 期中题 题型:单选题
查看答案和解析>>
科目:高中化学 来源:浙江省月考题 题型:单选题
查看答案和解析>>
科目:高中化学 来源:江西省月考题 题型:单选题
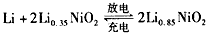
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com