
【题目】表为元素周期表的一部分.
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | |||
三 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
四 | ||||||||
(1)表中元素的非金属性最强;元素的金属性最强;元素的单质室温下呈液态(填写元素符号);
(2)表中元素⑦的原子结构示意图为
(3)表中元素⑥⑩氢化物的稳定性顺序为>(填写化学式,下同);
(4)表中元素⑩和最高价氧化物对应水化物的酸性:> .
(5)表中元素②和⑦最高价氧化物对应水化物的碱性> .
【答案】
(1)F;K;Br
(2)
(3)HF;HCl
(4)HClO4;HBrO4
(5)NaOH;LiOH
【解析】解:由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl、为K、为Ga、为Br.(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中,非金属性最强是F元素,金属性最强是K元素;元素Br的单质室温下呈液态,所以答案是:F;K;Br;(2)⑦为Na元素,原子核外有11个电子,有3个电子层,各层电子数为2、8、1,原子结构示意图为  ,所以答案是:
,所以答案是:  ;(3)非金属性F>Cl,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性:HF>HCl, 所以答案是:HF;HCl;(4)非金属性Cl>Br,元素非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:HClO4>HBrO4 ,
;(3)非金属性F>Cl,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性:HF>HCl, 所以答案是:HF;HCl;(4)非金属性Cl>Br,元素非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:HClO4>HBrO4 ,
所以答案是:HClO4;HBrO4;(5)金属性Na>Li,元素金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>LiOH,
所以答案是:NaOH>LiOH.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中,可能大量共存的是( )
A. 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br-
B. 水电离出的c(H+)=10-13mol·L-1的溶液中:Fe3+、K+、CO32-、SO32-
C. 室温下, Kw/c(H+)=0.1mol·L-1的溶液中:Al3+、Na+、SiO32-、HCO3-
D. 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
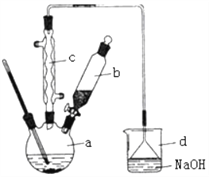
【题目】Ⅰ.溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液态溴。向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生的化学方程式为_______________________;继续滴加至液溴滴完。仪器a的名称是___________装置d中的作用是_______________________。仪器c为冷凝管,其进水口为__________________(填“上”或“下”)口。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______________________。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为____,要进一步提纯,下列操作中必须的是____。
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达方式或说法正确的是
A. 基态到激发态产生的光谱是发射光谱
B. 氯化铵的电子式:
C. 硫离子的核外电子排布式 1s22s22p63s23p4
D. NH3、H2O、CO2、HCl四分子中孤电子对最多的是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( ) 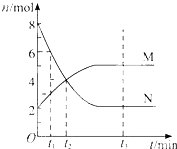
A.反应的化学方程式为:2MN
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度T℃时,在3个相同的恒容密闭容器中发生:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
△H =-41kJ·mol—1,其起始时投料的方式、各物质的量及其达平衡过程体系热量的变化如下表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系热量的变化(均为正值) | |||
CO | H2O(g) | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 32.8 kJ |
② | 8 | 2 | 0 | 0 | Q1 |
③ | 0 | 0 | 1 | 4 | Q2 |
下列说法中正确的是
A. 若经过10s容器①中反应达到平衡,则v(CO)=0.08 molL-1s-1
B. 容器②和容器③中热量变化:Q2=Q1=32.8 kJ
C. 若加入催化剂,改变了该反应的途径,反应的△H也随之改变
D. 保持相同条件,向平衡后的容器①中再加入0.1molCO 和0.4molCO2 (g),则平衡不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种正盐的混合溶液中含有0.2 molNa+、0.25molMg2+、0.4mol Cl-,则SO42-离子的物质的量为
A. 0.1 mol B. 0.3 mol C. 0.5mol D. 0.15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,A,B,C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
(1)甲同学实验(如图1)中选用的三种物质名称分别为:; 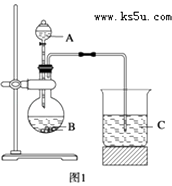
(2)乙同学实验(如图2)中:A处反应的离子方程式为:; B处的实验现象为:;该实验不能完全证明卤素性质的递变规律,请简述原因: . 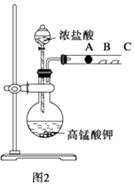
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com