
| A. | NaOH溶液 | B. | Na2CO3溶液 | C. | NaHSO3溶液 | D. | KI溶液 |
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖)$\stackrel{浓硫酸}{→}$ 6C+6H2O | |
| B. | 向AgNO3溶液中加入过量Na2S溶液后,再加入NaCl溶液,黑色沉淀变成白色:Ag2S+2Cl-=2AgCl↓+S2- | |
| C. | 将NH3通入滴有酚酞的水中,溶液变红:NH3+H2O?NH3•H2O?NH${\;}_{4}^{+}$+OH- | |
| D. | 明矾的水溶液pH<7:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
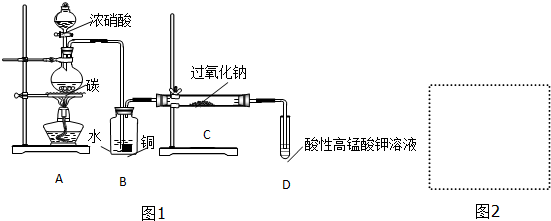
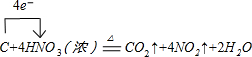 .
.| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,2.24 L苯含有的分子数为0.1NA | |
| B. | 100ml 1mol/L的NH4Cl溶液中,NH4+的数目为0.1NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中所含离子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32 g,电路中就转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
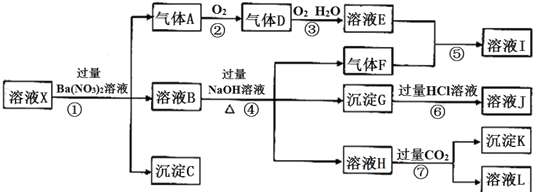
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘-131原子核外有5个电子层 | |
| B. | 碘-131原子的最外层有7个电子 | |
| C. | 具有放射性的碘-131原子比普通碘-127原子多4个中子 | |
| D. | 131I2与127I2互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与氢气反应的难易程度 | B. | 氢化物的熔沸点 | ||
| C. | 非金属性的强弱 | D. | 氢化物稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com