
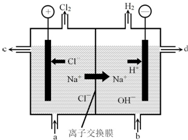
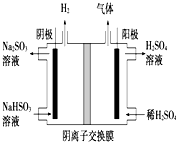
 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.
分析 (1)用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气、阴极上水得电子生成氢气和氢氧根离子;离子交换膜只有离子能通过,能防止氯气和碱反应、与氢气反应;
(2)H2SO3Ki1=1.54×10-2,Ki2=1.02×10-7,HClOKi1=2.95×10-8 ,说明ClO-水解程度大于SO32-;H2SO3Ki1=1.54×10-2 Ki2=1.02×10-7,H2CO3Ki1=4.3×10-7Ki2=5.6×10-11.说明SO32-水解程度小于CO32-;
(3)根据图知,SO2、I2、H2O是反应物,HI、H2SO4是生成物,根据反应物和生成物书写方程式;
(4)①a.2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mol-1
b.H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ•mol-1
将方程式a-2b得2SO3(g)?2SO2(g)+O2(g)焓变进行相应的改变;
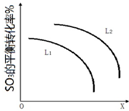
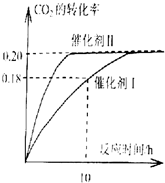
②由图可知,X越大,转化率越低;
分解反应为吸热反应,温度高,转化率大.
解答 解:(1)用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气、阴极上水得电子生成氢气和氢氧根离子,电池反应式为2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;离子交换膜只有离子能通过,能防止氯气和碱反应、与氢气反应,
故答案为:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;能得到纯度更高的氢氧化钠溶液、避免Cl2与H2反应(合理即给分);
(2)H2SO3 Ki1=1.54×10-2,Ki2=1.02×10-7,HClOKi1=2.95×10-8 ,说明ClO-水解程度大于SO32-,0.1mol/L NaClO溶液的pH大于0.1mol/L Na2SO3溶液的pH,依据电离平衡常数大小比较,H2SO3Ki1=1.54×10-2 Ki2=1.02×10-7,H2CO3Ki1=4.3×10-7Ki2=5.6×10-11.说明SO32-水解程度小于CO32-,浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)c(HCO3-)>c(HSO3-),
故答案为:大于;c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);
(3)根据图知,SO2、I2、H2O是反应物,HI、H2SO4是生成物,根据反应物和生成物书写方程式为SO2+I2+2H2O=2HI+H2SO4,故答案为:SO2+I2+2H2O=2HI+H2SO4;
(4)①a.2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mol-1
b.H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ•mol-1
将方程式a-2b得2SO3(g)?2SO2(g)+O2(g)△H=(+550kJ•mol-1
)-2(+177kJ•mol-1)=+196 kJ•mol-1,
故答案为:2SO3(g)?2SO2(g)+O2(g)△H=+196 kJ•mol-1;
②由图可知,X越大,转化率越低,升高温度转化率增大,则X表示压强;
由SO3(g)=SO2(g)+O2(g)△H>0,温度高,转化率大,图中等压强时L2对应的转化率大,则L1<L2,
故答案为:压强;L2>L1.
点评 本题考查电解原理、盖斯定律、图象分析,为高频考点,明确电解原理、盖斯定律及外界条件对化学平衡影响是解本题关键,侧重考查学生分析推断及计算能力,注意图象中曲线变化趋势与外界条件的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
 _.
_.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:| 温 度 | 200℃300℃400℃ |
| 平衡常数 | K1 K2 K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
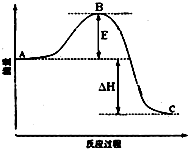 安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.
安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/L Na2CO3溶液中,CO32-的数目小于0.1NA个 | |
| B. | 标准状况下,6.0 g乙酸含有0.3 NA个C-H键 | |
| C. | 32gCu与足量硫黄充分反应,转移NA个电子 | |
| D. | 31g白磷(P4)中含有6 NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知CO2可以生产绿色燃料甲醇,反应如下:
已知CO2可以生产绿色燃料甲醇,反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com