
已知可逆反应:M(g)+N(g)⇌P(g)+Q(g)△H>0,请回答下列问题.
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol•L﹣1,c(N)=2.4mol•L﹣1,达到平衡后,M的转化率为60%,此时N的转化率为 .
(2)若反应温度升高,M的转化率 (填“增大”、“减小”或“不变”)
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol•L﹣1,c(N)=amol•L﹣1;达到平衡后,c(P)=2mol•L﹣1,a= .
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol•L﹣1,达到平衡后,M的转化率为 .
| 化学平衡的影响因素;化学平衡建立的过程;化学平衡的计算.. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)根据M的转化率为60%计算出M的浓度变化量,利用浓度变化量之比等于化学计量数之比求出N的浓度变化量,再根据转化率定义计算; (2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大; (3)由于温度不变,则平衡常数不变,与(1)相同,利用三段式计算平衡时各组分的浓度,代入平衡常数计算; (4)设平衡时M的浓度变化量为xmol/L,由于温度不变,则平衡常数不变,与(1)相同,利用三段式计算平衡时各组分的浓度,代入平衡常数计算x的值,在利用转化率等于计算. |
| 解答: | 解:(1)△c(M)=60%×1mol•L﹣1=0.6mol•L﹣1,浓度变化量之比等于化学计量数之比,所以△c(N)=△c(M)=0.6mol•L﹣1,故此时N的转化率 (2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大,故答案为:增大; (3))△c(M)=60%×1mol•L﹣1=0.6mol•L﹣1,则: M(g)+N(g)⇌P(g)+Q(g); 初始(mol/L):1 2.4 0 0 转化(mol/L):0.6 0.6 0.6 0.6 平衡(mol/L):0.4 1.8 0.6 0.6 故该温度下平衡常数k= 反应温度不变,反应物的起始浓度分别为c(M)=4mol•L﹣1,c(N)=amol•L﹣1;达到平衡后,c(P)=2mol•L﹣1,则: M(g)+N(g)⇌P(g)+Q(g); 初始(mol/L):4 a 0 0 转化(mol/L):2 2 2 2 平衡(mol/L):2 a﹣2 2 2 所以 故答案为:6; (4)设平衡时M的浓度变化量为为xmol/L,则: M(g)+N(g)⇌P(g)+Q(g); 初始(mol/L):b b 0 0 变化(mol/L):x x x x 平衡(mol/L):b﹣x b﹣x x x 所以 故M的转化率为 故答案为:41%. |
| 点评: | 本题考查化学平衡的有关计算、平衡常数的有关计算等,题目难度不大,注意理解化学平衡常数的用途,判断反应进行程度、判断反应进行的方向、计算转化率等. |


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
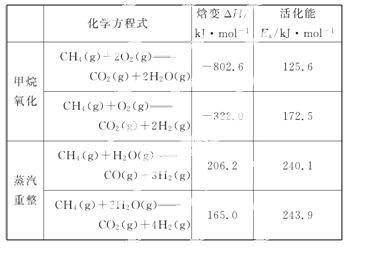
回答下列问题:
(1)反应CO(g)+H2O(g)====CO2(g)+H2(g)的ΔH=_____kJ·mol-1。
(2)在初始阶段,甲烷蒸汽重整的反应速率________甲烷氧化的反应速率(填“大于”“小于”或“等于”)。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g)  CO(g)+3H2(g)的Kp=______;随着温度的升高,该平衡常数_________ (填“增大”“减小”或“不变”)。
CO(g)+3H2(g)的Kp=______;随着温度的升高,该平衡常数_________ (填“增大”“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于___________________________________。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如图:
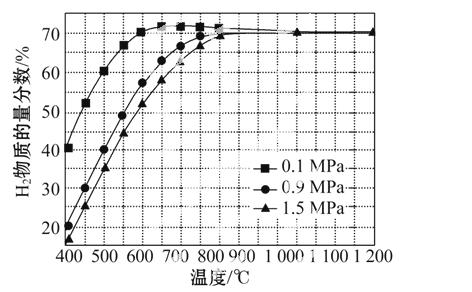
①若要达到H2物质的量分数>65%、CO物质的量分数<10%,以下条件中最合适的是______________。
A.600 ℃,0.9 MPa B.700 ℃,0.9 MPa
C.800 ℃,1.5 MPa D.1 000 ℃,1.5 MPa
②画出600 ℃,0.1 MPa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:
A.把100mL3mol·L-1的H2SO4跟100mLH2O混合,硫酸的物质的量浓度变为1.5mol·L-1
B.把100g20%的NaCl溶液跟100gH2O混合后,NaCl溶液的溶质质量分数是10%
C.把200mL3mol·L-1的BaCl2溶液跟100mL3mol·L-1的KCl溶液混合后, 溶液中的C(Cl-)仍然是3mol·L-1
溶液中的C(Cl-)仍然是3mol·L-1
D.把100mL20%的NaOH溶液跟100mLH2O混合后,NaO H溶液的质量分数是10%
H溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废气中氮氧化合物是造成污染的主要来源.为治污,工业上通常通入NH3与之发生下列反应:NOX+NH3→N2+H2O.现有NO、NO2的混合气3L,可用同温同压下的3.5LNH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比( )
|
| A. | 1:3 | B. | 2:1 | C. | 1:1 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如图所示)在保持400℃的条件下使之发生如下反应:2SO2+O2 2SO3.则下列描述正确的是( )
2SO3.则下列描述正确的是( )

|
| A. | 达到平衡所需要的时间:A容器更短 |
|
| B. | 达到平衡时:B容器中SO3的转化率更大 |
|
| C. | 达到平衡时:A容器中SO2的物质的量更多 |
|
| D. | 达到平衡后,向两容器中分别通入等量的氦气,A容器中SO3的体积分数增大,B容器中SO3的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl﹣离子完全沉淀.反应中消耗xmolH2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)/mol•L﹣1为( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
|
| A. | 氯气跟水反应:Cl2+H2O=2H++Cl﹣+ClO﹣ |
|
| B. | 硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42﹣=BaSO4↓ |
|
| C. | 碳酸钠溶液中加入少量稀盐酸:CO32﹣+H+=HCO3﹣ |
|
| D. | 铜与稀盐酸反应:Cu+2H+=Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法正确的是:( )
A.在标准状况下,11.2L氖气中含有NA 个氖原子
B.2 mol·L-1 的Na2SO4溶液中含有4NA个Na+
C.NA个水分子的相对分子质量之和等于水的摩尔质量
D.常温常压下,9克水所含的电子数为5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com