
【题目】向下例配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
A.[Co(NH3)3Cl3]
B.[Co(NH3)6]Cl3
C.[Co(NH3)4Cl2]Cl
D.[Co(NH3)5Cl]Cl2
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合物0.1mol完全燃烧得0.16mol二氧化碳和3.6克水.下列说法正确的是( )
A.一定有甲烷
B.一定是甲烷和乙烯
C.可能有乙烷
D.一定有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol.现将1molN2(g)、3molH2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为φ,下列说法中正确的是( ) 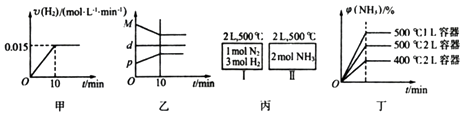
A.若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器I和II达到平衡时,NH3的体积分数为φ,则容器I放出热量与容器II吸收热量之和为92.4kJ
D.若起始加入物料为1 mol N2 , 3 mol H2 , 在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯是一种香料,其结构简式如图.下列有关肉桂酸异戊酯的叙述正确的是( ) 
A.不能使溴的四氯化碳溶液褪色
B.能与新制的Cu(OH)2共热生成红色沉淀
C.能与FeCl3溶液反应显紫色
D.能与热的浓硝酸和浓硫酸混合液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)主要用于制革、印染、电镀等.其水溶液中存在平衡:Cr2O72﹣+H2O2CrO42﹣+2H+
(1)已知有关物质溶解度如图1.用复分解法制备K2Cr2O7的操作过程是:向Na2Cr2O7溶液中加入(填化学式),搅拌溶解,调节溶液pH约为5,加热溶液至表面有少量晶体析出时, , 抽滤得到粗产品,再用重结晶法提纯粗产品.
(2)以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图2.
①不锈钢作极,写出该电极的电极反应式 .
②分析阳极区能得到重铬酸钾溶液的原因 .
③当铬酸钾的转化率达到x时,阳极液中K与Cr的物质的量之比为
(3)铬对环境能造成污染.某酸性废水中含有Cr2O72﹣ , 处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72﹣转化为毒性较低的Cr3+ , 再调节pH约为8,使铬元素沉降,分离出污泥后检测废水中Cr3+浓度,低于0.5mgL﹣1则达到排放标准.
①Na2S2O5参加反应的离子方程式为 .
②经上述工艺处理后的废水,理论上Cr3+浓度约为 mgL﹣1 .
(已知室温下Ksp[Cr(OH)3]≈6×10﹣31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是造纸、玻璃、纺织、制革等行业的重要原料.
(1)路布兰法制备纯碱:①食盐与硫酸反应生成硫酸钠;②将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成.第②步反应的化学方程式为 .
(2)①原盐水中含少量Mg2和Ca2 , 结合生产实际,精制盐水需要的试剂时、 . (填化学式)
②步骤 II保持在30﹣35℃进行,反应的化学方程式为 , 该反应能发生的原因是 . 该工艺中循环利用的物质是 .
③索尔维制纯碱不需要用到的一种设备是 (填正确答案标号).
A.吸氨塔 B.蒸氨塔 C.碳酸化塔 D.沸腾炉 E.石灰窑
④该工艺中食盐利用率大约只有70%,食盐损失的主要原因是 . 我国科学家侯德榜将合成氨工业得到的NH3和CO2引入纯碱的生产,向上述工艺的“母液”中通入NH3并加入食盐固体,降温结晶得到副产品(填化学式),剩余母液返回“吸氨”步骤,大大提高了食盐的利用率.
(3)纯碱产品中可能含有碳酸氢钠.用热重分析的方法测定纯碱中碳酸氢钠的质量分数为ω(NAHCO3)=(列出算式,所需数据用字母表示,并说明各字母的含义).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:W、Y、Z、T、M为前四周期元素,且原子半径依次增大.请填空:
(1)W,Z是形成化合物种类最多的两种元素,写出Z原子的核外电子排布图;
(2)化合物YW3极易溶于水的原因;YW3的分子构型为 . YW3属于(填“极性”或“非极性”)分子,其中Y的化合价为 .
(3)元素T的原子中电子共占据了7个轨道,则T在元素周期表周期族.T的化合物TY熔融时不导电,常用作砂轮及耐高温材料,由此推知,它属于(填编号字母);
a.离子晶体 b.原子晶体 c.分子晶体 d.无法判断
(4)M3+的3d轨道为半充满,则M的原子的电子排布式为 , M位于周期表的区(按电子的填入顺序划分),M的晶体中的粒子采用的是体心立方堆积,则该种堆积方式的配位数为 , 若其晶胞的边长为acm,M的摩尔质量为Mr g/mol,阿伏加德罗常数的值为NA , 则其密度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转化关系,A是由地壳中含量最多的金属元素组成的。请回答:
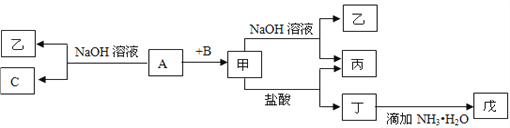
(1)写出下列物质的化学式:乙_______、丁_______、戊_______。
(2)写出甲物质在工业上的一种主要用途:______________________________。
(3)写出甲→乙+丙反应的离子方程式:______________________________________;
丁→戊反应的离子方程式:___________________________________________;
A→乙+C反应的化学方程式_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com