
【题目】高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如图:
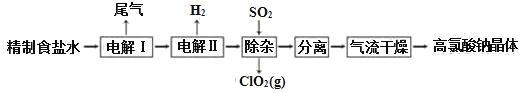
(1)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为______。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
除去盐水中的Br-可以节省电解过程中的电能,其原因是_____。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有_____(填化学式)。“电解Ⅱ”的化学方程式为____。
(3)“除杂”的目的是除去少量的未反应的NaClO3杂质,该反应的离子方程式为_____。“气流干燥”时,温度控制在80~100℃,温度不能过高的原因是_____。
【答案】BC 电解时Br-被氧化 Cl2 NaClO3+H2O![]() NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 温度太高,高氯酸钠晶体失去结晶水或分解
NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 温度太高,高氯酸钠晶体失去结晶水或分解
【解析】
由原料氯化钠到高氯酸钠晶体,氯的化合价升高,而整个流程中未加强氧化剂,所以通过电解实现了氯的不同价态的转化(电解过程即为氧化还原反应),将制得的盐水一次电解产生氯酸钠,得到的氯酸钠溶液进行再一次电解,生成高氯酸钠,然后通入二氧化硫除去其中的氯酸钠,最后进行分离提纯得到高氯酸钠晶体。
(1)NaOH可以除去Mg2+,钡试剂可以除去硫酸根,碳酸钠可以除去钙离子同时可以除去过量的钡离子,所以碳酸钠要在钡试剂之后加入,所以添加的试剂顺序为:先加NaOH,后加钡试剂,再加Na2CO3或先加钡试剂,后加NaOH,再加Na2CO3,所以选BC;Br-的还原性强于氯离子,所以电解过程中溴离子优先被氧化,消耗更多的电能;
(2)电解过程中阳极氯离子放电,主要生成氯酸根离子,也有部分产生氯气,而阴极氢离子放电,生成氢气,所以尾气有氢气和少量的氯气;电解Ⅱ氯酸根离子在阳极放电生成高氯酸根,而阴极是水电离产生的氢离子放电,生成氢气,所以电解反应方程式为:NaClO3+H2O![]() NaClO4+H2↑;
NaClO4+H2↑;
(3)由图示可知通入二氧化硫除去其中的氯酸根离子,Cl(+5→+4),S(+4→+6),根据得失电子守恒和电荷守恒,该反应的离子方程式为:2ClO3-+SO2=2ClO2+SO42-;温度太高晶体可能失水,同时温度太高可能使高氯酸钠分解。


科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X的化学式是_____、Y的化学式是_____、Z的名称是_____。
(2)由Y和Z组成,且Y和Z质量比为7:20的化合物的化学式(分子式)是_____。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的一种阳离子是_____。
(4)由X、Y、Z元素按原子个数比为4:2:3组成的化合物,该化合物的化学式(分子式)是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙属于桥环化合物,是一种医药中间体,可以通过以下反应制得:

下列有关说法正确的是
A. 甲分子中所有原子可能处于同一平面上
B. 乙可与H2按物质的量之比1∶2发生加成反应
C. 丙能使酸性高锰酸钾溶液、溴的CCl4溶液褪色,且原理相同
D. 等物质的量的甲、乙分别完全燃烧时,消耗氧气的质量之比为13∶12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y混合气体在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
A.平衡向右移动 B.a+b>c
C.Y的转化率提高 D.Z的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用环己醇制备环己酮,使用的氧化剂可以是次氯酸钠、重铬酸钾等。

已知:环己醇沸点:160.8℃,微溶于水;
环己酮沸点:155.6℃,微溶于水;
醋酸沸点117.9℃,和水以任意比例互溶。
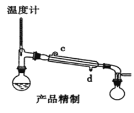
下列装置分别是产品的合成装置和精制装置示意图:

合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2mL环己醇和25mL冰醋酸。开动搅拌器,将40mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5min。然后,在室温下继续搅拌30min后,在合成装置中再加入30mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。回答下列问题:
(1)在合成装置中,甲装置的名称是_____________。
(2)三颈烧瓶的容量为_____________(填“50mL"、“100mL”或“250mL")。
(3)滴液漏斗具有特殊的结构,主要目的是_____________。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是_____________。然后加入精制食盐使之变成饱和溶液,将混合液倒入_____________中,分离得到有机层。
(5)用如图对粗产品进行精制,蒸馏收集_____________℃的馏分。
(6)检验环己酮是否纯净,可使用的试剂为_____________。
A.重铬酸钾溶液B.金属钠C.新制的氢氧化铜悬浊液D.醋酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析核电荷数为1 ~ 18的元素原子的核外电子层数和最外层电子数,回答下列问题:
(1)核电荷数为6和14的元素原子,它们的____________相同,____________不相同;核电荷数为15和16的元素原子,它们的____________相同,____________不相同;核电荷数为10和18的元素原子,它们的最外层电子数均为____________,它们的元素符号分别是____________、____________。
(2)某元素的原子核外有三个电子层,最外层电子数是核外电子总数的![]() ,该元素的元素符号是____________,原子结构示意图是____________。
,该元素的元素符号是____________,原子结构示意图是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是( )
A.铜的电解精炼中,若阳极质量减少32g,则转移电子的电子数为6.02×1023
B.吸热反应发生过程中要不断从外界获得能量,放热反应一定不需要吸收外界能量
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)ΔH=-285.8kJ/mol
D.已知稀溶液中:H+(aq)+OH-(aq)=H2O(l)ΔH=-53.7kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于53.7kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下CO2与NH3混合反应,可以合成尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH,若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是( )
CO(NH2)2(s)+H2O(g) ΔH,若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是( )
A.CO2与H2O(g)浓度相等
B.容器中气体的压强不再改变
C.2v(NH3)正=v(H2O)逆
D.容器中混合气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是 ( )
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. CaCO3的电离:CaCO3![]() Ca2++CO32-
Ca2++CO32-
C. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
D. Na2S溶液的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com