
【题目】为测定已部分变质的过氧化钠(假定杂质全部为碳酸钠)的纯度,设计了如下图所示的实验.图中Q为一具有良好弹性的气球(气球不参与反应,也不会被腐蚀),称取一定量的样品放入其中,按图安装的实验装置打开分液漏斗的活塞,将稀硫酸滴入气球中.请填空:
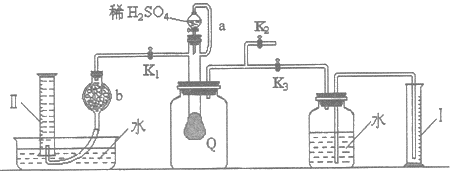
(1)Q内发生反应生成了两种气体,这两种气体的分子式为O2、CO2,写出反应的离子方程式:________。
(2)导管a的作用是________。
(3)为测定反应生成气体的总体积,滴稀硫酸前必须关闭________(填K1、K2、K3,下同),打开________。
(4)当上述反应停止后将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是________。
(5)b中装的固体试剂是________。
【答案】2Na2O2+4H+=4Na++2H2O+O2↑、CO32-+2H+=H2O+CO2↑ 平衡分液漏斗上下的压强使顺利流下 K1、K2 K3 气球Q慢慢缩小,量筒Ⅱ内液面下降 碱石灰(或生石灰,或氢氧化钠)
【解析】
根据常见化学实验基础操作及注意事项分析;根据过氧化钠的化学性质分析;
(1)变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑、Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,这两个反应的离子方程式为2Na2O2+4H+=4Na++2H2O+O2↑、CO32-+2H+=H2O+CO2↑;
(2)为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等,所以导管a的作用是平衡分液漏斗上下的压强使顺利流下;
(3)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积,所以滴稀H2SO4前必须关闭K1、K2打开K3;
(4)反应停止,打开K2,再缓缓打开K1,广口瓶内外相通,气球Q慢慢缩小,量筒Ⅱ内液面下降;
(5)想要收集到纯净O2需要把混合气体中的CO2除去,故混合气体通过b碱石灰(或生石灰,或氢氧化钠)吸收CO2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用如下反应,可实现氯的循环利用:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1

下列说法正确的是
A. 升高温度能提高HCl的转化率
B. 加入催化剂,能使该反运的焓变减小
C. 1molCl2转化为2molCl2原子放出243kJ热量
D. 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.5 mol Cu2S和足量稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O。则参加反应的硝酸中被还原的硝酸的物质的量是
A. 5 mol B. 1.5 mol C. 6 mol D. 1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人教版高中化学选修4实验2-3中用到了硫代硫酸钠,某化学兴趣小组对这一物质展开了如下探究。

实验一.制备Na2S2O3·5H2O
通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ; S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)
Na2S2O3(aq)
(1)写出A中的化学反应方程式___________________________________。
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有_________________________(写一条)
(3)装置E的作用是____________________。
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为_________________________。
实验二.性质探究
(5)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是_______________________________________________________。
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式________________________________________。
实验三.Na2S2O3的应用
(7)用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.0100 mol·L-1的Na2S2O3标准溶液进行滴定,反应完全时,相关数据记录如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液的体积/mL | 18.02 | 20.03 | 17.98 | 18.00 |
部分反应的离子方程式为:① Cr2O72-+6I-+14H+===3I2+2Cr3++7H2O
② I2+2S2O32-===S4O62-+2I-
滴定时Na2S2O3标准溶液应该用_____________________(填仪器名称)盛装,该废水中Ba2+的物质的量浓度为_______________________span>。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
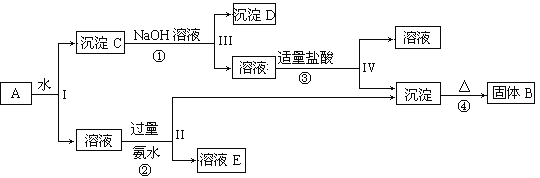
据此回答下列问题:
(1)I、II、III、IV四步中分离溶液和沉淀所采取的操作名称是____________。
(2)①、③反应的离子方程式:
①_____________________________________________________________;
③_____________________________________________________________。
(3)有人认为③用盐酸不是太好,改为通入足量的一种气体,这种气体为______。该离子反应方程式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式或离子方程式
(1)过氧化钠与二氧化碳反应的化学方程式:_______________________________。
(2)铁与水蒸气的反应的化学方程式:___________________________________。
(3)碳酸钠溶液与盐酸反应离子方程式:___________________。
(4)碳酸氢钠溶液与氢氧化钠溶液反应离子方程式_____________________。
(5)氧化铝与氢氧化钠溶液反应离子方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是

A. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方 程式为:MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com