
| A. | 根据原子核外电子排布的特点,Zn在周期表中属于ds区元素 | |
| B. | P4和CH4都是正四面体形分子且键角都为109°28′ | |
| C. | NH3分子中N原子和H2O分子中O原子的杂化类型不相同 | |
| D. | 原子间只通过共价键而形成的三维网状结构的晶体一定具有高的熔、沸点及硬度 |
分析 A、Zn的外围电子排布式为3d104S2,位于元素周期表的ds区;
B、P4是四原子的正四面体,而CH4是五原子的正四面体;
C、NH3分子中N原子和H2O分子中O原子的杂化类型都是sp3杂化;
D、原子间只通过共价键而形成的三维网状结构的晶体是原子晶体,而原子晶体具有高的熔、沸点及硬度.
解答 解:A、Zn的外围电子排布式为3d104S2,位于元素周期表的ds区,故A正确;
B、P4是四原子的正四面体,键角是60°,而CH4是五原子的正四面体键角都为109°28′,故B错误;
C、NH3分子中N原子和H2O分子中O原子的杂化类型相同,都是sp3杂化,所以杂化方式相同,故C错误;
D、原子间只通过共价键而形成的三维网状结构的晶体是原子晶体,而原子晶体具有高的熔、沸点及硬度,故D正确;
故选:AD.
点评 本题考查了晶体的结构和性质,难度不大,注意原子晶体的原子以共价键相结合,具有高的熔、沸点及硬度.


科目:高中化学 来源: 题型:解答题
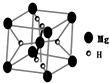 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物 | |
| B. | Y和其他四种元素均可形成至少两种的二元化合物 | |
| C. | RY2能与Y、Z形成的一种化合物反应生成Y2 | |
| D. | Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. +nOHCH2CH2OH$\stackrel{一定条件}{→}$
+nOHCH2CH2OH$\stackrel{一定条件}{→}$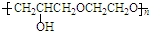 +nHCl
+nHCl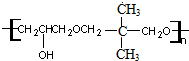 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素中离子半径最大的为M | |
| B. | Y、Z、M的氢化物中,M的氢化物沸点最高 | |
| C. | 四种元素最多可形成两种盐 | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物,不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠可用于制备木材防火剂 | B. | 硅单质广泛用于光纤通讯 | ||
| C. | 硅酸可由二氧化硅与水反应制得 | D. | 水晶项链是硅酸盐制品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com