
| A. | 碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键 | |
| B. | 碳原子性质活泼,可以跟多数元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成稳定的双键和叁键 | |
| D. | 多个碳原子可以形成长度不同的链、支链及环,且链、环之间又可以相互结合 |
分析 A.碳原子最外层有4个电子,碳原子与碳原子、其他原子(如氢原子)形成4个共价键;
B.碳原子化学性质不活泼;
C.碳原子最外层有四个电子,碳原子之间可以形成稳定的单键,又可以形成稳定的双键和三键,还能成环;
D.碳原子最外层有四个电子,碳原子之间可以形成稳定的单键,又可以形成稳定的双键和三键,还能成环.
解答 解:A.碳原子最外层有4个电子,碳原子与碳原子、其他原子(如氢原子)形成4个共价键达到稳定结构,故A正确;
B.碳原子性质不活泼,故B错误;
C.碳原子之间成键方式具有多样性,碳原子与碳原子之间不仅可以形成共价单键,还可以形成双键、单键,不仅可以形成碳链还可以形成碳环,故C正确;
D.碳原子最外层有四个电子,碳原子之间可以形成稳定的单键,又可以形成稳定的双键和三键,多个碳原子可以形成长度不同的链、支链及环,且链、环之间又可以相互结合,故D正确.
故选B.
点评 本题考查了有机物种类繁多的原因及有机物的性质等,难度不大,注意基础知识的积累和掌握.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

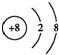
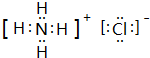 ,I的化学式Mg(OH)2;
,I的化学式Mg(OH)2;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;A、F两元素组成的化合物电子式为Na+[:H]-.
;A、F两元素组成的化合物电子式为Na+[:H]-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常情况下,甲烷跟强酸、强碱、强氧化剂都不反应 | |
| B. | 甲烷的化学性质比较稳定,点燃前不必验纯 | |
| C. | 甲烷与氯气反应,无论生成CH3Cl、CH2Cl2、CHCl3、CCl4,都属于取代反应 | |
| D. | 甲烷的四种有机氯代产物都难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
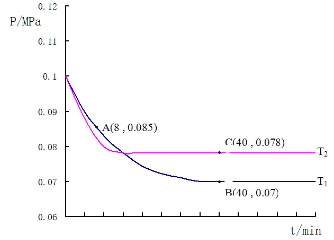 SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO与NaOH溶液反应 H++OH-═H2O | |
| B. | CaCO3与稀盐酸反应 CO32-+2H+═CO2↑+H2O | |
| C. | Fe和稀H2SO4反应 2Fe+6H+═2Fe3++3H2↑ | |
| D. | 盐酸和Ba(OH)2溶液反应 H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
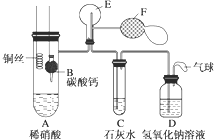
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com