
| A. | 酒精和四氯化碳 | B. | 煤油和汽油 | C. | 酒精和水 | D. | 植物油和水 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
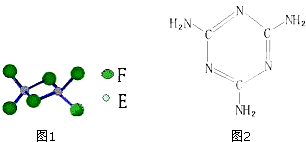
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯气和液氯是两种不同物质 | |
| B. | 新制氯水溶液中存在两个平衡状态 | |
| C. | 久置的氯水,溶液的PH会变小 | |
| D. | 向氯水中滴加紫色石蕊试剂,溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸和氢氧化铜 | B. | 硫酸和氢氧化钠溶液 | ||
| C. | 醋酸和氢氧化钡溶液 | D. | 稀硝酸和氨水混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和的FeCl3溶液滴入沸水中形成Fe(OH)3胶体 | |
| B. | 蛋白质溶液可观察到丁达尔现象 | |
| C. | Fe(OH)3胶体可观察到丁达尔现象 | |
| D. | 胶体分散系中所有粒子的直径都不在1~100 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳元素 | B. | 氢元素 | C. | 氧元素 | D. | 氢、氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体 | |
| B. | 氧化铝的熔点很高,可用于制造熔融烧碱的坩埚 | |
| C. | 在含FeC12杂质的FeCl3溶液中通入足量C12后,充分加热除去过量的C12,不能得到纯净的FeC13溶液 | |
| D. | 饱和氯水既有酸性又有漂白性,加入适量NaHCO3固体,其漂白性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质浓度(mol/L)时间(min) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com