
分析 (1)Cl元素的化合价既升高又降低,转移e-;
(2)Cu元素的化合价升高,N元素的化合价降低,转移2e-;
(3)O元素的化合价升高,Cl元素的化合价降低,转移12e-;
(4)Cl元素的化合价升高,Mn元素的化合价降低,转移2e-.
解答 解:(1)该反应中Cl元素化合价由0价变为+1价、Cl2为还原剂,Cl元素化合价又由0价降低为-1价,则Cl2为氧化剂,其得失电子最小公倍数是1,用双线桥标出该反应电子转移的方向和数目为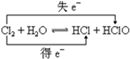 ,故答案为:
,故答案为: ;氧化剂Cl2,还原剂Cl2;
;氧化剂Cl2,还原剂Cl2;
(2)该反应中Cu元素化合价由0价变为+2价、Cu为还原剂,部分N元素化合价由+5价变为+4价,则HNO3为氧化剂,其得失电子最小公倍数是2,用双线桥标出该反应电子转移的方向和数目为 ,
,
故答案为: ;氧化剂HNO3;还原剂Cu;
;氧化剂HNO3;还原剂Cu;
(3)该反应中O元素的化合价升高-2价升高为0价,则KClO3为氧化剂;Cl元素化合价从+5价降低为-1价,则KClO3为还原剂,其得失电子最小公倍数是12,用双线桥标注电子转移为 ,
,
故答案为: ;氧化剂KClO3;还原剂KClO3;
;氧化剂KClO3;还原剂KClO3;
(4)该反应中Cl元素部分化合价由-1价升高为0价、Cl2为还原剂,Mn元素化合价由+4价降低为+2价,则MnO2为氧化剂,其得失电子最小公倍数是2,用双线桥标出该反应电子转移的方向和数目为 ,故答案为:
,故答案为: ;氧化剂MnO2,还原剂HCl.
;氧化剂MnO2,还原剂HCl.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子表示方法的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铜有优良的导电性 | B. | 铜在干燥的空气中不易被氧化变质 | ||
| C. | 铜较易冶炼,属常见金属 | D. | 铜的密度比较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 产生气体的体积:①>② | |
| B. | 两极上析出物质的质量:①>② | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | 电极反应式:①中阳极:4OH--→2H2O+O2↑+4e-;②中阴极:2H++2e--→H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com