
| A、同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3?H2O,c(NH4+)由大到小的顺序是:①>③>②>④ |
| B、常温时,将等体积的盐酸和氨水混合后pH=7,则c(NH4+)>c(Cl-) |
| C、0.2mol?L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D、0.01mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
| A、①④⑤ | B、②④⑤ |
| C、②③④ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大气污染物主要来自化石燃料和工业生产过程产生的废气 |
| B、形成酸雨的主要物质是硫氧化物和氮氧化物(NOX) |
| C、绿色化学的核心就是在生产过程中减少污染 |
| D、水华、赤潮等水体污染是由于含氮、磷的大量污水任意排放造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、W的原子序数可能是Y的原子序数的2倍 |
| B、X可能为氢元素 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、X、Y、Z、W四种元素的最外层电子数之和可能为25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| B、蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素 |
| C、用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
| D、向盛有少量苯酚稀溶液试管中滴加少量稀溴水,边滴边振荡,有白色沉淀出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化剂 |
| B、还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
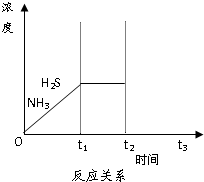 脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.
脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com