
【题目】下列组成活细胞的元素中,含量最多的原子是( )
A. 碳 B. 氧 C. 氢 D. 氮
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)铝热反应在工业生产中的重要用途之一是焊接钢轨,其反应的化学方程式为:______________________;“硅材料”又被称为信息材料,作为半导体材料广泛用于制造集成电路的是____________(填化学式)。
(2)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示):___________________。
(3)反应2H2CrO4 + 3H2O2 = 2Cr(OH)3 + 3O2↑+ 2H2O中H2O2的变化过程为H2O2→O2。
① 该反应的还原剂是______________________________。
② 在该反应方程式中标明电子转移的方向和数目:_______________
2H2CrO4 + 3H2O2 = 2Cr(OH)3 + 3O2↑+ 2H2O
③ 若反应中转移了3 mol电子,则产生的气体在标准状况下体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)认识有机化合物的结构与类别有助于理解其性质。
①下列有机化合物与苯甲酸(![]() )互为同系物的是________(填字母,下同)。
)互为同系物的是________(填字母,下同)。
a. 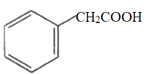 b.
b. 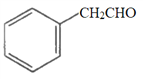 c.
c. 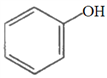
②下列有机化合物易溶于水的是________。
a. 苯 b. 乙烷 c. 乙醇
③下列试剂可用于鉴别乙酸和乙醛的是________。
a. 水 b. 银氨溶液 c. 稀硫酸
(2)扁桃酸(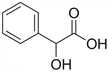 )是一种重要的化工原料。
)是一种重要的化工原料。
①扁桃酸分子中有________种不同化学环境的氢。
②扁桃酸中含氧官能团的名称为________和________。
③1 mol扁桃酸最多能与________mol金属钠反应
(3)化合物C是一种医药中间体,由A制备C的物质转化路线如下:
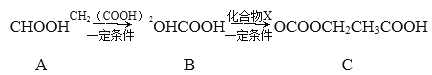
①1个A分子中一定共平面的碳原于有________个。
②B暴露在空气中易变色,其原因是___________________________________。
③化合物X的分子式为C3H5O2Cl,其结构简式为_________________________________。
④D是B的一种同分异构体。D能发生银镜反应,也能与NaHCO3溶液反应放出气体,且苯环上的一氯代物有2种。写出符合条件的D的一种结构简式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于组成生物体的化学元素,下列叙述不正确的是 ( )
A. 组成生物体的化学元素,可以分成大量元素和微量元素
B. 不同的生物体内化学元素种类和含量基本相同
C. 组成生物体的化学元素,没有一种是生物界所特有的
D. 组成玉米和人的最基本元素是碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中,正确的是( )
①离子化合物中可能含共价键 ②共价化合物中可能含离子键
③离子化合物中只含离子键 ④共价化合物中不含离子键
A.①②B.②③
C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示。下列叙述错误的是

A. 已知H3FeO4+的电离半衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pII=4吋,溶液中![]()
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 向pH=5的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O
D. pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂和氮的相关化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题
(1)Li的氢标电势是最负的,达到-3.045V,与水有很大的反应倾向,然而将Li单质加入水中,其反应烈程度远不如其他碱金属,试解释原因___________________________
(2)基态氮原子中,核外电子占据的最高能层的符号为____________,核外电子能量最高的电子的电子云轮廓图形状为____________
(3)氮元素既可与其他元素形成正离子,比如N2O5结构中存在NO2+的结构,其空间构型为____________,氮原子的杂化形式为____________;它也可以形成全氮的正离子,比如 N5AsF6中存在高能量的N5+,N5+的空间构型为____________。
(4)下图为一种N和Li形成的二元化合物的晶体结构,试在图中划出其晶胞__________,该化合物的化学式为____________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(l)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)_______.
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________。
(3)下列关于氧化铝的叙述正确的是_______
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能溶于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________,此方法的缺点是处理后的水中生成了A1O3-,仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。
已知25℃时,Ksp[Al(OH)3] = l.3×l0-33 Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13
AlO2-+H++H2O K=1.0×10-13
25℃时,若欲使上述处理后的水中A1O2-浓度降到1.0×10-6mol/L,则应调节至pH=_______。
此时水中c(A13+)=__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com