
| ||
| △ |
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
| A、分子中含有两个氢原子的酸一定是二元酸 |
| B、向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
| C、明矾可用于水的消毒、杀菌 |
| D、葡萄糖注射液不能产生丁达尔效应,不属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 |
| B、配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 |
| C、Na2CO3溶液不可保存在带磨口塞的玻璃瓶中 |
| D、泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 4 |
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
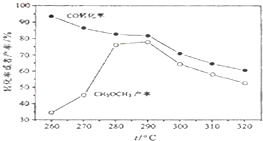 (除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:
(除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com