
 普通锌锰干电池的简图(如图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽.在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:Zn+2NH4++2MnO2═[Zn(NH3)2]2++Mn2O3+H2O关于锌锰干电池的下列说法中正确的是( )
普通锌锰干电池的简图(如图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽.在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:Zn+2NH4++2MnO2═[Zn(NH3)2]2++Mn2O3+H2O关于锌锰干电池的下列说法中正确的是( )| A. | 当该电池电压逐渐下降后,利用电解原理能重新充电复原 | |
| B. | 电池负极的电极反应式为:2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O | |
| C. | 该电池碳棒可用铜棒代替,但是工作电压会下降 | |
| D. | 外电路中每通过0.1 mol电子,锌的质量理论上减小6.5g |
分析 A、一次电池不能重复使用,二次电池能重复使用.
B、原电池负极上失电子发生氧化反应.
C、铜棒导电能力没有碳棒强.
D、根据锌和转移电子之间的关系式计算.
解答 解:A、一次电池不能重复使用,二次电池能重复使用,干电池是一次电池,所以当该电池电压逐渐下降后,不能利用电解原理能重新充电复原,故A错误.
B、该原电池放电时,负极上Zn失电子发生氧化反应,电极反应式为:Zn-2e-═Zn2+,故B错误.
C、铜棒导电能力没有碳棒强,所以该电池碳棒用铜棒代替,但是工作电压会下降,故C正确.
D、Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O 转移电子
65g 2mol
3,25g 0.1mol
所以外电路中每通过0.1mol电子,锌的质量理论上减小3.25g,故D错误.
故选C.
点评 本题考查了原电池原理,难度不大,会根据正负极上得失电子判断电极反应类型.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
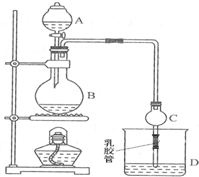 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3COOCH2CH3+H218O.
CH3COOCH2CH3+H218O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,消耗的氧气乙烷最多 | |
| B. | 可借助于核磁共振氢谱区分乙醇和二甲醚这两种物质 | |
| C. | CH3CH(CH3)CH(CH3)CH(C2H5)CH2CH3的名称:2,3-二甲基-4-乙基己烷 | |
| D. | 石油裂解和油脂的皂化都是高分子生成小分子的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象 |
| I | 先向2mL 0.1mol/L FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | |
| II | 先向2mL 0.1mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1mol/L KI溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸滴在锌粒上:Zn+2H+═Zn2++H2↑ | |
| B. | Ba(OH)2溶液滴入稀硫酸中:Ba2++SO42-═BaSO4↓ | |
| C. | 稀盐酸滴在大理石上:CO32-+2H+═CO2↑+H2O | |
| D. | 氯气通入FeCl2溶液中:Cl2+Fe2+═Fe3++2 Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时增大 | B. | 同时减小 | C. | V1 增大,V2 减小 | D. | V1 减小,V2增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com