
| m |
| M |
| N |
| NA |
| V |
| Vm |
| 1000ρω |
| M |
| mg |
| Mg/mol |
| m |
| M |
| m |
| M |
| m |
| M |
| 3m |
| M |
| 3mNA |
| M |
| 3mNA |
| M |
| m |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
| 1000ρω |
| M |
| 1000da% |
| M |
| 1000da% |
| M |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
 A、B、C、D、E是原子序数依次增大的五种元素.B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题.
A、B、C、D、E是原子序数依次增大的五种元素.B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
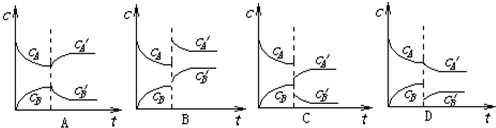
| 序号 | 平衡移动的因素 | 平衡移动的方向(填“逆反应方向”或“正反应方向”) |
| A | ||
| B | ||
| C | ||
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,组成一个原电池.当电解质溶液为稀硫酸时:
如图所示,组成一个原电池.当电解质溶液为稀硫酸时:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2个 | B、3个 | C、4个 | D、5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用丁达尔效应区分溶液与胶体 |
| B、NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 |
| C、配制硫酸溶液时,先在量筒中加入一定量的水,再慢慢加入浓硫酸 |
| D、浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后抹上碳酸钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com