
| A. | 医学上可用碳酸钡代替硫酸钡用作“钡餐” | |
| B. | 生理盐水用于医疗输液是因为它属于强电解质 | |
| C. | 医学上用液氮作制冷剂是因为液氮的沸点很低 | |
| D. | 水中的钢闸门连接电源负极,利用了牺牲阳极的阴极保护法 |
分析 A.碳酸钡能够溶于盐酸;
B.生理盐水为氯化钠的水溶液,属于混合物;
C.液氮汽化吸收大量的热;
D.水中的钢闸门连接电源的负极,Fe作电解池的阴极,属于外加电源的阴极保护法.
解答 解:A.碳酸钡能够溶于盐酸生成可溶性氯化钡溶液,钡为重金属离子有毒,故A错误;
B..生理盐水为氯化钠的水溶液,属于混合物,不是电解质,故B错误;
C.液氮的沸点很低,医学上用液氮作制冷剂,故C正确;
D.水中的钢闸门连接电源负极,利用了外加电源的阴极保护法,故D错误;
故选:C.
点评 本题考查了物质的性质及用途,性质决定用途,熟悉碳酸钡、生理盐水、液氮的性质是解题关键,注意金属的电化学防护原理,题目难度不大,注意对相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | CH≡C-CH3 | C. | CH2=CH-CH=CH2 | D. | CH3-CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 不论以何种方式使反应体系的压强增大,化学反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应到达平衡的时间 | |
| D. | 当该反应到达平衡时,SO2、O2、SO3都存在于反应体系中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2为0.8mol/L,O2为0.4 mol/L | B. | SO2为0.5 mol/L | ||
| C. | SO3为0.8 mol/L | D. | SO2、SO3均为0.3 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
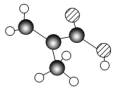 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸纤维属于酯类 | |
| B. | 顺-2-丁烯与反-2-丁烯的沸点不同 | |
| C. | 脱氧核糖核酸(DNA)是高分子有机物 | |
| D. | 由苯酚与溴水的反应可知,苯环影响了羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O?H3O++OH- | B. | H2S?H++HS- | C. | NaHS=Na++HS- | D. | HCO3-=H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
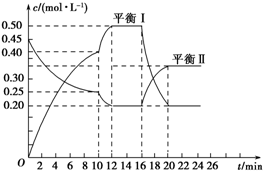 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:解答题
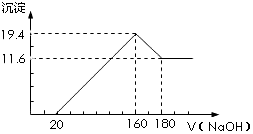 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com