
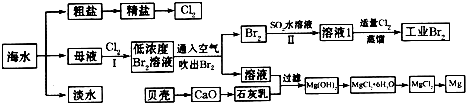
海水是重要的资源,可以制备一系列物质(见图4)。

下列说法正确的是( )
A.步骤②中,应先通CO2,再通NH3
B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中的SO42—、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013届山西省山大附中高三1月月考化学试卷(带解析) 题型:单选题
海水是重要的资源,可以制备一系列物质(见图4)。
下列说法正确的是( )
| A.步骤②中,应先通CO2,再通NH3 |
| B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水 |
| C.步骤④、⑤、⑥反应中,溴元素均被氧化 |
| D.除去粗盐中的SO42—、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com