
| A、0.04 |
| B、0.04mol/L |
| C、0.04mol/(L?S) |
| D、0.8mol/(L?S) |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极附近溶液的碱性不变 |
| B、充电过程是化学能转化为电能的过程 |
| C、充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
| D、放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
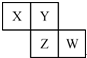 短周期元素X、Y、Z、W在元素周期表中的相对位置如图,其中Y与Z可形成化合物ZY2,且Y、Z元素的质量分数都是50%.下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图,其中Y与Z可形成化合物ZY2,且Y、Z元素的质量分数都是50%.下列说法正确的是( )| A、元素Y和元素Z的最高正化合价相同 |
| B、第一电离能:Y>X,W>Z |
| C、气态氢化物的热稳定性顺序为X<Y<Z |
| D、元素W的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都不能证明 |
| B、③④⑤能证明 |
| C、③⑤能证明 |
| D、只有⑤能证明 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.8gH2O中含有的电子数为nA |
| B、1molCO中含有的原子数为nA |
| C、1molNa2CO3在溶液中电离出的Na+数为nA |
| D、标准状况下,22.4L苯中含有的分子数为nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca(OH)2═Ca2++2(OH)- |
| B、FeCl2═Fe2++3Cl- |
| C、H2SO4═H++SO42- |
| D、Al2(SO4)3═2Al3++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
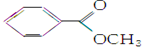 是一种重要的工业用有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.
是一种重要的工业用有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.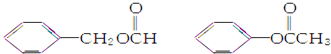
| 丙的分子式 | C7H8O |
| 丙的部分性质 | 熔融状态下能与钠反应放出氢气 |
| 与乙酸能发生酯化反应 |
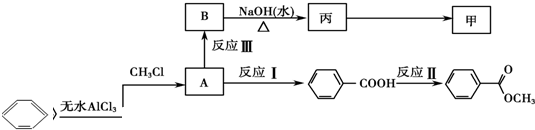
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com