
| A、Ba(OH)2?8H2O和NH4Cl反应 |
| B、Zn和稀H2SO4反应制氢气 |
| C、灼热的炭与水蒸气反应 |
| D、工业合成氨的反应 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a一定小于或等于b |
| B、aw1一定等于b w2 |
| C、t℃时KCl溶解度一定大于100w1 |
| D、w1一定大于w2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸 |
| B、分离苯和硝基苯的混合物,可用蒸馏法 |
| C、可用苯将溴从溴苯中萃取出来 |
| D、可用水来鉴别苯、乙醇、四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 仪器 | 试剂 | 相应实验目的 |
| A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、钥匙、玻璃棒 | 食盐,蒸馏水 | 配制一定物质的量浓度的NaCl溶液 |
| B | 烧杯、分液漏斗、胶头滴管、玻璃棒 | 溴水、四氯化碳、溴化钠、碘化钠 | 除去溴化钠溶液中少量的碘化钠 |
| C | 烧杯、玻璃棒、蒸发皿 | CuSO4溶液 | CuSO4溶液的浓缩结晶 |
| D | 分液漏斗、烧瓶、锥形瓶、导管、橡皮塞 | 稀盐酸、大理石、硅酸钠溶液 | 证明非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、简单甘油酯是纯净物,混合甘油酯是混合物 |
| B、植物油是一种良好的有机溶剂,可以用来萃取溴水中的溴单质 |
| C、天然油脂都是混合物,没有恒定的熔点、沸点 |
| D、纯天然高分子是纯净物,合成高聚物一定是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
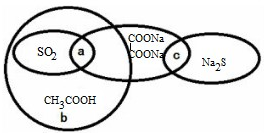
| A、SO2的水溶液能导电,所以SO2是电解质 |
| B、b可以代表含氧元素的离子化合物 |
| C、SO2、Na2C2O4均可作还原剂使酸性KMnO4溶液褪色 |
| D、CH3COOH与Na2S的反应称为酸碱中和反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com