
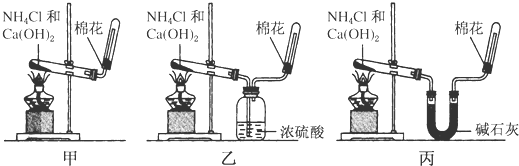
分析 (1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气;
(2)根据氨气的溶解性和密度选择收集氨气的方法;
(3)氨气能与硫酸反应而被硫酸吸收;
(4)碳酸氢铵加热分解生成氨气、二氧化碳和水,可用碱石灰除杂,但不能用NH4HCO3固体代替NH4Cl固体;
(5)氨气能使湿润的红色石蕊试纸变蓝,所以可以用湿润的红色石蕊试纸检验.
解答 解:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气易溶于水,不能用排水法收集,氨气密度比空气小,应用向下排空法收集,
故答案为:NH3的密度小于空;
(3)氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,
故答案为:乙;
(4)碳酸氢铵加热分解生成氨气、二氧化碳和水,其中可用碱石灰吸收二氧化碳和水,只有丙能做到,
故答案为:丙;
(5)氨气能使湿润的红色石蕊试纸变蓝,所以可以用湿润的红色石蕊试纸检验,检验方法是:将湿润的红色石蕊试纸置于管口,若试纸变蓝,则说明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满),
故答案为:将湿润的红色石蕊试纸置于管口,若试纸变蓝,则说明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满).
点评 本题考查实验氨气的制取及性质,为高频考点,题目难度中等,明确物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意氨气的实验室制取方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用BaCl2溶液鉴别硫酸铵和氯化铵两种固体 | |
| B. | 用尝味道的方法鉴别蔗糖溶液和硫酸溶液 | |
| C. | 用稀盐酸鉴别碳酸钾和硝酸钾两种固体 | |
| D. | 用灼烧闻气味的方法鉴别丝绸和棉布 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应---二氧化碳 | B. | 光化学烟雾---二氧化氮 | ||
| C. | 酸雨---二氧化碳 | D. | 赤潮---含氮、磷的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1Na2CO3溶液中:c(Na+)>c(CO32-)>c(H2CO3)>c(HCO3-) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| C. | 在0.1mol•L-1Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(H CO3-)>c(H+) | |
| D. | 在0.1mol•L-1Na2CO3溶液中:c(Na+)+c(H+)═c(CO32-)+c(OH-)+c(H CO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 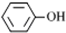 和 和 互为同系物 互为同系物 | |
| B. | 配制FeSO4溶液时,需加入少量铁粉和稀盐酸,既防止氧化又抑制水解 | |
| C. | 活化分子之间的碰撞不一定都是有效碰撞反应 | |
| D. | 对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 升高温度,促进c(CO32-)水解,pH增大 | |
| B. | 离子浓度:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| C. | 离子浓度:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | 离子浓度:c(Na+)>c(CO32-)>c(H+)>c(OH-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7 | |
| B. | 同体积、同密度的C2H4和CO,两种气体的分子数一定相等 | |
| C. | 配制450 mL 0.1 mol•L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g | |
| D. | 1 L 0.45 mol•L-1 NaCl溶液中Cl-的物质的量浓度比0.1L 0.15 mol•L-1 AlCl3溶液大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com