
下列叙述正确的是( )
A.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
B.Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀
C.钠在常温下不容易被氧化
D.Na2O2可作供氧剂,而Na2O不行
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列说法中正确的是( )
①等物质的量的N2和CO所含分子数均为NA
②常温下,4 g CH4含有NA个C-H共价键
③1 mol Na2O2与水完全反应时转移电子数为2NA
④将NA个NH3分子溶于1 L水中得到1 mol·L-1的氨水
⑤25 ℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA
⑥1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
A.①③⑤ B.②⑤ C.②④⑥ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:填空题
(2016·银川模拟)工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:2Al2O3+6Cl2 4AlCl3+3O2。
4AlCl3+3O2。
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是_____________________。
(2)加入焦炭后的化学反应可表示为Al2O3+C+Cl2AlCl3+X↑,设计实验确定气体X的__________________。
(3)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为________________________。
(4)以铝土矿为原料可以通过以下途径提纯氧化铝:
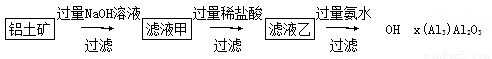
①写出滤液甲中溶质的化学式:___________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式:__________________________。
③要进一步获得金属铝,工业上采用的冶炼方法是_______________,
有关反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:选择题
(2016·绍兴一中质量诊断)甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各向其中加入1 mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是( )
A.甲中沉淀一定比乙中的多
B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少
D.实验过程中甲中和乙中的现象始终保持一致
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:选择题
(2016·济南模拟)下列各组物质相互混合反应后,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④Na2O2投入CuCl2溶液中
A.只有①④ B.只有③ C.只有②③ D.只有①③④
查看答案和解析>>
科目:高中化学 来源:2017届河北省邯郸市高三上学期第一次月考化学试卷(解析版) 题型:实验题
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-===5I-+IO3-+3H2O
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显血红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显血红色,该红色物质是______(用化学式表示);CCl4中显紫红色的物质是______(用电子式表示)。
②第二份试剂中加入足量KI固体后,反应的离子方程式为__________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式:__________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?____(填“是”或“否”),并说明理由:_________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是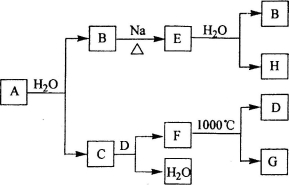
________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:________________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省邯郸市高三上学期第一次月考化学试卷(解析版) 题型:选择题
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A. ②⑤ B. ②③⑥ C. ①⑤⑥ D. ③⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省漳州市高一(下)期中化学试卷(解析版) 题型:填空题
下列各组中:
①金刚石②12C③液氯④14C⑤CH3CH2CH2CH3⑥氯水⑦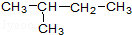 ⑧
⑧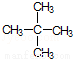 ⑨C60
⑨C60
属于同素异形体的是 (用序号回答,下同),属于同分异构体的是 属于同位素的是 .
查看答案和解析>>
科目:高中化学 来源:2017届山西省协作体高三上学期开学考试化学试卷(解析版) 题型:实验题
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
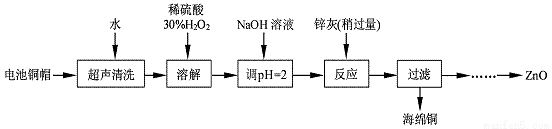
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式: ;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 ;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3[ | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为 ,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会 (填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)= mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
② ;③过滤;
④ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com