
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
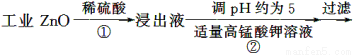
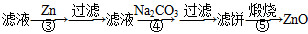
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有______________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是________________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2,取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于__________。
(1)Fe2+和Mn2+ MnO4—+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4—+3Mn2++2H2O=5MnO2↓+4H+ 铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质
(2)置换反应 镍
(3)取少量水洗液于试管中,滴入1~2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净
(4)1
【解析】从分析整个流程图入手,明确每步发生的反应,从而解决相关问题。
(1)在反应②中,通过调节溶液的pH,高锰酸钾能将溶液中的Fe2+氧化为Fe3+,将
Mn2+氧化为MnO2而除去;若溶液的pH过低,Fe2+、Mn2+将很难生成沉淀而除去。
(2)第一次过滤后的滤液中含有的阳离子有Zn2+、Ni2+、H+等,加入锌后可将Ni置换出来,故滤渣中还含有金属镍。
(3)反应④生成的沉淀为ZnCO3,同时生成Na2SO4,若沉淀未洗涤干净,洗涤液中应含有SO42—和Na+,故只要对洗涤液中是否含有SO42—进行检验即可。
(4)煅烧过程中ZnCO3、Zn(OH)2均发生分解反应生成ZnO,根据关系式ZnCO3·xZn(OH)2~(x+1)ZnO,可得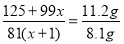 ,故x=1。
,故x=1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:填空题
菱锌矿的主要成分是碳酸锌,还含有少量的Fe2O3、FeO、CuO等杂质。如图是以菱锌矿为原料制取轻质氧化锌的一种工艺流程,该流程还可以得到两种副产品——海绵铜和铁红。
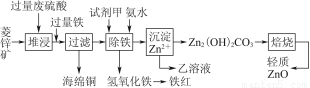
请结合下表数据,回答问题:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.3 | 9.7 |
Fe3+ | 1.5 | 3.2 |
Zn2+ | 6.2 | 8.0 |
(1)下列试剂中,________(填代号)可作为试剂甲的首选。
A.KMnO4 B.Cl2 C.H2O2 D.浓硝酸
根据所选试剂写出与之反应的离子方程式:________________________________________________________________________________________________________________________________________________。
(2)氢氧化铁固体会吸附一些SO42-,如何洗涤Fe(OH)3固体以及如何判断是否洗涤干净?
洗涤方法:______________________________________________________________,判断是否洗涤干净的方法是_______________________________________。
(3)除铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是______________;调节溶液pH时,除了氨水外,还可以加入下列物质中的________。
a.Zn b.ZnO c.Zn(OH)2 d.CuO
(4)经测定乙溶液中仍含有少量的Fe3+和Zn2+。若c(Fe3+)为4.0×10-17 mol·L-1,则c(Zn2+)为______________ mol·L-1。(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=1.2×10-17)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十电解质溶液练习卷(解析版) 题型:选择题
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/mol·L-1 | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=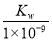 mol·L-1
mol·L-1
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
下图表示的是某物质所发生的( )
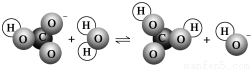
A.取代反应 B.水解反应 C.中和反应 D.电离过程
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十六物质结构与性质练习卷(解析版) 题型:填空题
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同
B元素原子的核外p电子总数比s电子总数少1
C原子p轨道上成对电子数等于未成对电子数,且与A同周期
D元素的族序数与周期数的差为4,且不与A元素在同一周期
E位于周期表中第七列
F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子
(1)A的基态原子最外层有______种不同运动状态的电子。
(2)E2+的基态核外电子排布式为____________________。
(3)A、B、C三种元素的最简单氢化物的熔点由低到高的顺序是________。A、B、C三种元素组成的分子中与AC2互为等电子体的分子为________________(用元素符号表示)。
(4)BD3中心原子的杂化方式为________,其分子空间构型为____________。
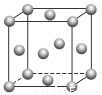
(5)用晶体的X射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如下图),又知该晶体的密度为ρ g·cm-3,晶胞中该原子的配位数为______________;F的原子半径是________ cm(阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:实验题
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒,存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
资料:①H2S可溶于水?约1∶2?,其水溶液为二元弱酸。
②H2S可与许多金属离子反应生成沉淀。
③H2S在空气中燃烧,火焰呈淡蓝色。
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。
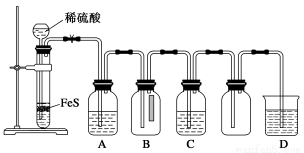
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为___________________。
②B中的现象是__________________。
③C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为______________。
④D中盛放的试剂可以是________(填字母序号)。
a.水 b.盐酸
c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小明同学又设计了下列实验。
| 实验操作 | 实验现象 |
实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
已知:电离平衡常数:
H2S Kal=1.3×10-7,Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2,Ka2=5.6×10-8
①根据上述实验,可以得出结论:在__________条件下,+4价硫化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是________(填字母序号)。

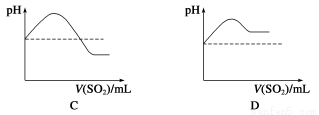
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应______。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:选择题
下列有关物质用途的说法,错误的是( )
A.二氧化硫常用于漂白纸浆 B.漂粉精可用于游泳池水消毒
C.晶体硅常用于制作光导纤维 D.氧化铁常用于红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十七有机化学基础练习卷(解析版) 题型:填空题
可降解聚合物P的合成路线如下:
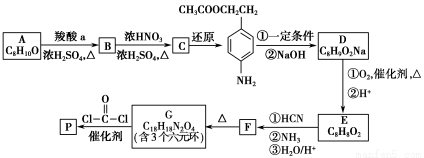
已知:
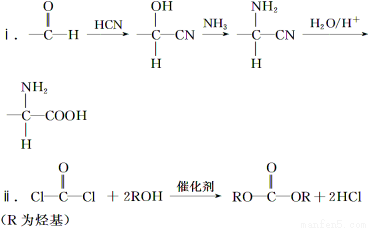
(1)A的含氧官能团名称是________。
(2)羧酸a的电离方程式是________。
(3)B→C的化学方程式是________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是________。
(5)E→F中反应①和②的反应类型分别是________。
(6)F的结构简式是________。
(7)聚合物P的结构简式是________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:选择题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是( )

A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B.阳极的电极反应式为C+2O2--4e-=CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com