
( 6 分)Ⅰ.有机物A的红外光谱图分别如下:

(1)符合该条件的相对分子质量最小的A的结构简式为:_________________________________。
Ⅱ.相对分子质量不超过100的有机物B, 既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。 B完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现B的氢谱如下:

(2)B的结构简式为:___________________________________。
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:阅读理解
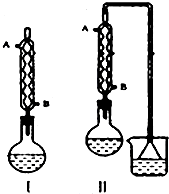 由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:
由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:| 浓H2SO4 |
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)海洋植物如海带.海藻中含有丰富的碘元素,其主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:(已知: 2I-+ Cl2=2Cl-+I2)
(1)指出提取碘的过程中有关的实验操作名称:① ,③ ;
(2)过程②中充入适量Cl2的目的是 ;
(3)操作③中所用的有机试剂可以是 (只填一种),简述要把碘水变成碘有机溶液对于提取晶体碘的优点 .
(4)操作过程③可以分解为如下几步:
A.检验分液漏斗活塞和上口的玻璃塞是否漏液;
B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.静置、分层。
F.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
G.旋开活塞,用烧杯接收溶液;
H.从分液漏斗上口倒出上层液体;
上述F步操作的目的是: ;
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一新生入学考试化学试卷(解析版) 题型:填空题
(6 分)从Ca、C 、S、H、O 、N六种元素中选择适当的元素按要求填空。
(1)人体中元素含量最高的是 __________ ;
(2)常用作干燥剂的一种酸_____________;(填化学式,下同)。
(3)能作为燃料的有机化合物是__________:
(4)既可用来消毒杀菌,又可用来改良酸性土壤的碱是__________;
(5)造成煤气中毒的是__________。
(6)绿色植物进行光合作用吸收的是________________;
查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃省高三上学期第一阶段考试化学试卷 题型:填空题
(6分)在有机溶剂里,使 与
与 发生完全反应,释放出
发生完全反应,释放出 ,同时得到一种白色晶体A,A的熔点为113℃,在减压时,50℃即可升华,测得A蒸气的密度(标准状况)为
,同时得到一种白色晶体A,A的熔点为113℃,在减压时,50℃即可升华,测得A蒸气的密度(标准状况)为 。
。
(1)通过计算得出A的化学式___________。
(2)生成A晶体的化学方程式为_____________。
(3)分子结构测定结果表明,同种元素的原子在A分子中所处的环境毫无差别,试写出A的结构式:____________。
查看答案和解析>>
科目:高中化学 来源:2013届甘肃省天水市高二上学期期末考试化学试卷 题型:填空题
(6分)利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机
物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物
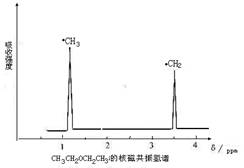
分子中氢原子的种类和数目。例如乙醚的结构简式为:CH3—CH2—O—CH2—CH3
其核磁共振谱中给出的峰值 (信号)有两个,如下图所示:
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是
A.CH3CH3 B. CH3COOH C. CH3COOCH3 D. CH3OCH3
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:
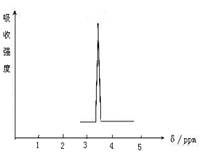 _____
,请预测B的核磁共振氢谱上有 个峰(信号)
_____
,请预测B的核磁共振氢谱上有 个峰(信号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com