
| A、2a+3(b+d-e)+c kJ/mol |
| B、a+3(2b+d-e)-c kJ/mol |
| C、3(d+e-b)+c-2a kJ/mol |
| D、2a+3(b-d-e)-c kJ/mol |
| E、2a+3(b-d-e)-c kJ/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 2012年6月16日18时37分神舟九号飞船从酒泉卫星发射中心长征二号F型火箭发射升空,先后与天宫一号目标飞行器在轨成功进行了两次交会对接.长征二号F型火箭用的燃料是液体偏二甲基肼C2H8N2,氧化剂是液体N2O4,已知1.5g偏二甲基肼完
2012年6月16日18时37分神舟九号飞船从酒泉卫星发射中心长征二号F型火箭发射升空,先后与天宫一号目标飞行器在轨成功进行了两次交会对接.长征二号F型火箭用的燃料是液体偏二甲基肼C2H8N2,氧化剂是液体N2O4,已知1.5g偏二甲基肼完| A、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(l)△H=-50kJ?mol-1 |
| B、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-50kJ?mol-1 |
| C、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(l)△H=-2000kJ?mol-1 |
| D、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-2000kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.65 | B、0.72 |
| C、1.00 | D、1.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、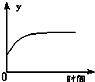 表示反应进行过程中气体平均相对分子质量的变化 |
B、 表示反应进行过程中气体密度的变化 |
C、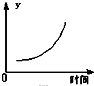 表示反应达到平衡后,移去一些焦炭后水蒸气的百分含量的变化(忽略表面积的影响) |
D、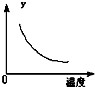 表示反应达到平衡后,升高温度CO的百分含量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
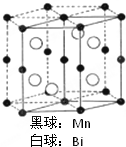 磁光盘机(Magnetic Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的.如图是该物质的晶体结构,其化学式可表示为( )
磁光盘机(Magnetic Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的.如图是该物质的晶体结构,其化学式可表示为( )| A、Mn2Bi |
| B、MnBi |
| C、MnBi3 |
| D、Mn4Bi3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)t℃时水的离子积为1×10-13,则该温度(选填大于、小于或等于)
(1)t℃时水的离子积为1×10-13,则该温度(选填大于、小于或等于)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com