
【题目】目前电解法制烧碱通常采用离子交换膜法,阳(阴)离子交换膜不允许阴(阳)离子通过。则下列叙述中错误的是( )

A. NaOH、H2均在Ⅰ区产生
B. 图中a为阴离子交换膜
C. 使用离子交换膜可以有效地隔离NaOH和Cl2,阻止二者之间的反应
D. 电解时往Ⅲ区的溶液中滴加几滴甲基橙,溶液先变红后褪色
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列反应属于皂化反应的是
A. 乙酸乙酯在碱性条件下水解 B. 硬脂酸甘油酯在酸性条件下水解
C. 软脂酸甘油酯在酸性条件下水解 D. 硬脂酸甘油酯在碱性条件下水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 戊烯共有5种同分异构体,它们的熔点、沸点各不相同
B. 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应
C. 1mol油脂完全水解生成1mol甘油和3mol高级脂肪酸(盐)
D. 聚合物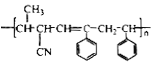 可由单体
可由单体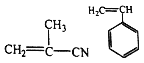 和
和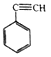 加聚制得
加聚制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A>B>C>D ②四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲:![]() 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
乙:![]() 无色,无气味并且易燃。是常见的一种基础能源。
无色,无气味并且易燃。是常见的一种基础能源。
丙:![]() 有强氧化性的弱酸,可以用于消毒杀菌。
有强氧化性的弱酸,可以用于消毒杀菌。
请根据上述信息回答下列问题。
(1)B元素在元素周期表中的位置为________________,请写出BC2分子的电子式:_______________。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式:
①A元素的单质与物质甲发生反应:_____________________________________。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生反应:______________________________________________________。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入硫酸酸化的硫酸亚铁溶液。滴加过程中的现象为:
①试管中溶液变成深棕黄色,发生反应的离子方程式为 ;
②开始有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,继续滴加溶液,静置一段时间,试管底部出现红褐色沉淀。请回答“片刻后反应变得剧烈”的原因是a b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.32 g氧气所含的原子数目为2×6.02×1023
D.3.01×1023个一氧化碳分子中含有0.5 mol的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地有软锰矿和闪锌矿两座矿山,它们的组成(质量分数)如下:
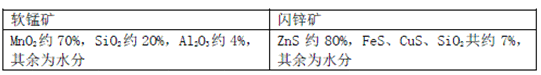
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
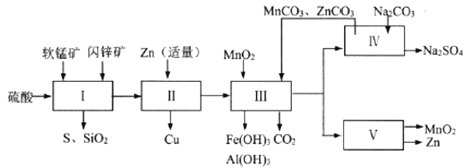
请回答下列问题。
(1)流程I所得滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程I中被氧化的物质有_______种。
(2)流程II中反应的离子方程式为_____________。
(3)氢氧化物开始沉淀的pH如下表:
氢氧化物 | Fe(0H)3 | Al(0H)3 | Fe(0H)2 |
开始沉淀pH | 1.5 | 3.3 | 7.6 |
①流程III中MnO2的作用是将Fe2+氧化成Fe3+,不直接生成Fe(OH)3沉淀的原因是_________。
②MnCO3和ZnCO3的作用是______________。
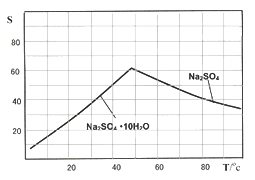
(4)下图是Na2SO4和Na2SO4·10H2O的溶解度(g/100g水)曲线,又知MnCO3和ZnSO4的溶解度随温度的升高而增大,则流程IV得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、_____、干燥,要“趁热”过滤的原因是:______________。
(5)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要购买的原料是_______。
(6)流程V的反应为:MnSO4+ZnSO4+2H2O ![]() MnO2+Zn+2H2SO4,写出阳极反应式________。
MnO2+Zn+2H2SO4,写出阳极反应式________。
(7)MnO2和Zn可按物质的量之比1 : 1 生产锌-锰干电池,则从主产MnO2和Zn的角度计算,所用软锰矿和闪锌矿的质量比大约是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)及其化合物是用途广泛的化工原料,硼可与多种元素形成化合物。
(1)B的价电子轨道表示式为________ 。
(2)BF3与NH3可以通过配位键形成NH3·BF3。
① 基态![]() 原子的核外电子有________种不同的运动状态
原子的核外电子有________种不同的运动状态
② NH3 的键角________CH4的键角(填“大于”、“小于”或“等于”)。BF3为________分子(填“极性”或“非极性”)。
③ 在NH3·BF3所形成的配位键中,________原子提供空轨道。
(3)氮化硼(BN)晶体有多种结构。六方氮化硼与石墨相似,具有层状结构;立方氮化硼与金刚石相似,具有空间网状结构。它们的晶体结构如下图所示。

① 六方氮化硼和立方氮化硼中,B原子的杂化方式分别为_______、_______。
② 六方氮化硼能像石墨一样做润滑剂,原因是_______;但它不能像石墨一样导电,可能的原因是_______.
③ 已知立方氮化硼的晶胞参数(即晶胞的边长)为acm,则立方氮化硼的密度为_______g/cm3(只要求列算式,不必计算出结果,阿伏加德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com