
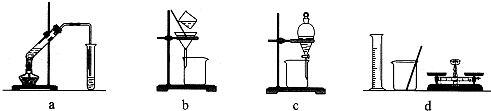
| A、a组:制备少量乙酸乙酯 |
| B、b组:除去粗盐水中的泥沙 |
| C、c组:用CCl4提取碘水中的碘 |
| D、d组:配制100 mL 1.00 mol/L NaCl溶液 |


科目:高中化学 来源: 题型:
| A、减少CO2的排放,可以减少酸雨的产生 |
| B、减少SO2的排放,可以从根本上消除雾霾 |
| C、“天宫一号”使用的碳纤维,是一种新型有机高分子材料 |
| D、用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、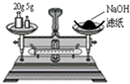 称量氢氧化钠固体 |
B、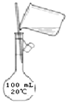 配制150mL 0.10mol/L盐酸 |
C、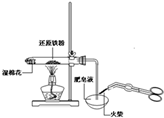 检验铁粉与水蒸气反应产生的氢气 |
D、 分离两种互溶但沸点相差较大的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 |
| B、采用天然石材装修家居,可减轻室内甲醛污染但会导致一定量的放射性物质的污染 |
| C、汽油中添加含铅化合物Pb(C2H5)4,可提高汽油的抗爆震性能,有利于改善大气环境 |
| D、PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的还原剂是Cu2S |
| B、当1mol O2发生反应时,还原剂所失去电子的物质的量为4mol |
| C、O2发生了氧化反应 |
| D、CuSO4即是氧化产物,又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
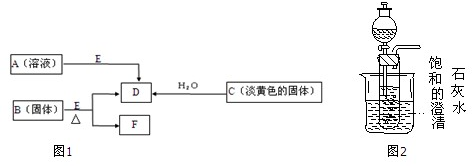
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2SO2(g)+O2(g)?2SO3(g) | N2(g)+3H2(g)?2NH3(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 绿矾 |
| H+ |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置所示,C、D、E、F都是惰性电极,
如图装置所示,C、D、E、F都是惰性电极,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com