
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)依据表中数据分析,随温度升高,平衡常数减小,说明平衡逆向进行;
(2)计算浓度商和平衡常数比较分析判断反应进行方向.
解答 解:(1)依据表中数据分析,随温度升高,平衡常数减小,说明平衡逆向进行正反应为放热反应,△H<0;
故答案为:<;
(2)在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,CO(g)+2H2(g)?CH3OH(g),浓度商Q=$\frac{2}{2×{3}^{2}}$=$\frac{1}{9}$<K=0.270,反应正向进行;
故答案为:A.
点评 本题考查了反应的热效应和化学反应进行的方向,学生要掌握用浓度商和平衡常数的大小来判断反应的进行方向是关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯水中通入H2S气体,溶液的pH变小 | |
| B. | 在饱和氯水中通入SO2气体,溶液的pH变小 | |
| C. | 在饱和氯水中加入CaCO3,平衡向右移,溶液的pH变大 | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中微粒浓度:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
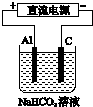 某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.
某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
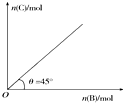 盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )
盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )| A. | 降低温度,则图中θ>45° | |
| B. | 平衡后再加入B,正反应速率增大,逆反应速率减小 | |
| C. | 平衡时B的转化率为50% | |
| D. | 平衡后再加入A,体系内气体密度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由反应可确定:氧化性HClO3>HClO4 | |
| B. | 变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12+I2+6H2O→12H++8Cl-+2IO3- | |
| C. | 若氯酸分解所得的混合气体的平均摩尔质量为47.6g/mol,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 若化学计量数a=8,b=3,则该反应转移电子数为20e |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
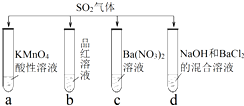
| A. | 试管a中实验可以证明具有漂白性 | |
| B. | 试管b中溶液褪色,说明具有强氧化性 | |
| C. | 试管c中能产生白色沉淀,说明具有还原性 | |
| D. | 试管d中能产生白色沉淀,该沉淀完全溶于 稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O和18O原子的核外电子排布不相同 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | HF、HCl、HBr、HI的熔沸点逐渐升高 | |
| D. | 干冰和二氧化硅熔化时所克服微粒间的相互作用相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com