
”¾ĢāÄæ”ææÉÄę·“Ó¦A£Øg£©+3B£Øg£©2C£Øg£© ”÷H=©Q kJ/mol£¬ÓŠ¼×”¢ŅŅĮ½øöČŻ»żĻąĶ¬ĒŅ²»±äµÄĆܱÕČŻĘ÷£¬Ļņ¼×ČŻĘ÷ÖŠ¼ÓČė1molAŗĶ3molB£¬ŌŚŅ»¶ØĢõ¼žĻĀ“ļµ½Ę½ŗāŹ±·Å³öČČĮæĪŖQ1 kJ”£ŌŚĻąĶ¬µÄĢõ¼žĻĀ£¬ĻņŅŅČŻĘ÷ÖŠ¼ÓČė2mol C“ļµ½Ę½ŗāŗóĪüŹÕČČĮæĪŖQ2kJ£¬ŅŃÖŖQ1=4Q2”£ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ£Ø””””£©
A. ŅŅÖŠCµÄ×Ŗ»ÆĀŹĪŖ20%
B. Q1+Q2=Q
C. “ļµ½Ę½ŗāŗó£¬ŌŁĻņŅŅÖŠ¼ÓČė0.2 molA”¢0.6molB”¢1.6molC£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅʶÆ
D. ŅŅÖŠµÄČČ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ2C£Øg£©A£Øg£©+3B£Øg£© ”÷H=+4Q2kJmol©1
”¾“š°ø”æD
”¾½āĪö”æ
ÓÉQ1=4Q2£¬æÉÖŖ”÷n¼×(A)=4”÷nŅŅ(A)£¬Éč¼×ÖŠ“ļµ½Ę½ŗāŹ±×Ŗ»ÆĮĖxmolA£¬Ōņ”÷nŅŅ(A)=![]() mol£¬
mol£¬
¼× A(g)+3B(g)2C(g)
ĘšŹ¼(mol)£ŗ 1 3 0
×Ŗ»Æ(mol)£ŗ x 3x 2x
Ę½ŗā(mol)£ŗ1-x 3-3x 2x
ŅŅ A(g)+3B(g)2C(g)
ĘšŹ¼(mol)£ŗ0 0 2
×Ŗ»Æ(mol)£ŗ![]()
![]() x
x ![]() x
x
Ę½ŗā(mol)£ŗ![]()
![]() x 2-
x 2-![]() x
x
ĄūÓĆ”°Ņ»±ßµ¹·Ø”±£¬æÉÖŖ”°1 mol A”¢3 mol B”±Óė”°2 mol C”±ŹĒµČŠ§ĪļĮĻ£¬ĖüĆĒŌŚĶ¬ĪĀĶ¬ČŻµÄĢõ¼žĻĀ½ØĮ¢µÄĘ½ŗāדĢ¬ĶźČ«ĻąĶ¬£¬Ōņ1-x=![]() £¬x=0.8”£
£¬x=0.8”£
A£®¼×ČŻĘ÷ÖŠæŖŹ¼¼ÓČė1molAµÄŗĶ3molBÓėŅŅČŻĘ÷ÖŠæŖŹ¼¼ÓČė2mol CĪŖĶźČ«µČŠ§Ę½ŗā£¬Ę½ŗāŹ±ĻąĶ¬×é·ÖµÄĪļÖŹµÄĮæĻąµČ£¬¹ŹŅŅÖŠCµÄ×Ŗ»ÆĀŹ=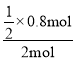 ”Į100%=20%£¬¹ŹAÕżČ·£»
”Į100%=20%£¬¹ŹAÕżČ·£»
B£®¼×ČŻĘ÷ÖŠæŖŹ¼¼ÓČė1molAµÄŗĶ3molBÓėŅŅČŻĘ÷ÖŠæŖŹ¼¼ÓČė2mol CĪŖĶźČ«µČŠ§Ę½ŗā£¬¼×“ļµ½Ę½ŗāŹ±·Å³öČČĮæĪŖQ1 kJ”£ŌŚĻąĶ¬µÄĢõ¼žĻĀ£¬ŅŅ“ļµ½Ę½ŗāŗóĪüŹÕČČĮæĪŖQ2kJ£¬ŌņÓŠQ=Q1+Q2£¬¹ŹBÕżČ·£»
C£®ĄūÓĆ”°Ņ»±ßµ¹·Ø”±£¬æÉÖŖŌŁ¼ÓČė”°0.2 mol A”¢0.6 mol B”¢1.6 mol C”±ÓėŌŁ¼ÓČė”°2 mol C”±µČŠ§£¬ŌŚŗćĪĀŗćČŻĢõ¼žĻĀ£¬Ļąµ±ÓŚŌö“óŃ¹Ēæ£¬Ę½ŗāĻņÉś³ÉCµÄ·½ĻņŅĘ¶Æ£¬¹ŹCÕżČ·£»
D£®A(g)+3B(g)2C(g) ”÷H=©Q kJ/mol£¬Ōņ2C(g)A(g)+3B(g) ”÷H=+QkJmol©1£¬ŅņĪŖQ=Q1 +Q2=4Q2+Q2=5Q2£¬Ņņ“Ė”÷H=+5Q2kJmol©1£¬¹ŹD“ķĪó£»
¹ŹŃ”D”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃĒĻõõ£°±(NOCl)ŹĒÓŠ»śŗĻ³ÉÖŠµÄÖŲŅŖŹŌ¼Į£¬ĪŖ»ĘÉ«ĘųĢå»ņŗģŗÖÉ«ŅŗĢå(ČŪµć-64.5”ę£¬·Šµć-5.5”ę)£¬¾ßÓŠ“Ģ±Ē¶ń³ōĪ¶£¬ÓöĖ®ŗĶ³±ĘųĖ®½ā£¬ÓŠ¶ąÖÖ·½·ØÖʱø”£
(1)½«5g¾300”ęĻĀøÉŌļĮĖ3h²¢ŃŠĻøµÄKCl·Ūĩװ 50mL“ųÓŠ½ÓĶ·¼°³éÕęæÕÓĆ»īČūµÄ²£Į§ČŻĘ÷ÄŚ”£½«ČŻĘ÷¾”Įæ¼õŃ¹£¬ŌŚ¼õŃ¹ĻĀĶØČė0.002molNO2”£·“Ó¦12”«36min¼“æÉĶź³É£¬NO2ŗģ×ŲÉ«ĻūŹ§£¬³öĻÖ»ĘÉ«ŃĒĻõõ£ĀČ£¬Ķ¬Ź±»¹µĆµ½Ņ»ÖÖŃĪ£¬øĆŃĪµÄ»ÆѧŹ½ĪŖ_____________£¬ĀČ»Æ¼ŲŠčŅŖ”°øÉŌļ”±µÄŌŅņŹĒ_____________________________”£
(2)ŹµŃéŹŅæÉÓÉĀČĘųÓėŅ»Ńõ»ÆµŖŌŚ³£ĪĀ³£Ń¹ĻĀŗĻ³ÉŃĒĻõõ£ĀČ£¬×°ÖĆČēĶ¼ĖłŹ¾£ŗ
¢ŁŅĒĘ÷aµÄĆū³ĘĪŖ____________________________£»
¢ŚB×°ÖƵÄ×÷ÓĆŹĒ____________________________£»
¢ŪŹµŃéæŖŹ¼Ź±£¬ĻČ“ņæŖK1£¬¹Ų±ÕK2”¢K3£¬ŌŁ“ņæŖ·ÖŅŗĀ©¶·»īČūµĪČėŹŹĮæĻ”ĻõĖį£¬µ±¹Ū²ģµ½×°ÖĆCÖŠ________________Ź±£¬“ņæŖK3Ļņ×°ÖĆDČż¾±ĘæÖŠĶĘČėøÉŌļ“æ¾»µÄCl2£¬µ±ĘæÖŠ³äĀś»ĘĀĢÉ«ĘųĢåŹ±£¬ŌŁ¹Ų±ÕK1”¢K3£¬“ņæŖK2ÖʱøNOCl”£
(3)²ā¶Ø²śĘ·“æ¶Č£ŗČ”(2)ÖŠw g DÖŠŅŗĢ¬²śĘ·ČÜÓŚÕōĮóĖ®£¬ÅäÖĘ³É250 mLČÜŅŗ£»ÓĆĖįŹ½µĪ¶Ø¹Ü×¼Č·ĮæČ”25.00 mLĖłÅäÖĘČÜŅŗӌ׶ŠĪĘæÖŠ£¬µĪ¼Ó¼øµĪK2CrO4ČÜŅŗ×÷ÖøŹ¾¼Į£¬ÓƵĪ¶Ø¹ÜŹ¢×°c mol”¤L-1 AgNO3±ź×¼ČÜŅŗµĪ¶ØÖĮÖÕµć£¬Ļūŗıź×¼ČÜŅŗĢå»żĪŖV mL”£(ŅŃÖŖ£ŗAg2CrO4ĪŖשŗģÉ«¹ĢĢ壬ŗöĀŌŌÓÖŹ²ĪÓė·“Ó¦)
¢ŁŹ¢×°AgNO3±ź×¼ČÜŅŗµÄµĪ¶Ø¹ÜŹĒ_____________(Ģī”°ĖįŹ½”±»ņ”°¼īŹ½”±)×ŲÉ«µĪ¶Ø¹Ü£»ÅŠ¶Ļ“ļµ½µĪ¶ØÖÕµćµÄ·½·ØŹĒ_____________”£
¢ŚøĆ²śĘ·“æ¶ČĪŖ_____________(ÓĆ“śŹżŹ½±ķŹ¾)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¶ŌÓŠ¹ŲŹĀŹµ·ÖĪö²»ÕżČ·µÄŹĒ
Ń”Ļī | ŹĀŹµĆčŹö | Ļą¹ŲÖŖŹ¶·ÖĪö |
A | ŃčÓļ”°ÕżŌĀ“ņĄ×Āó¹Č¶Ń”±”¢”°Ą×Óź·Ź×ƼŚ”± | ×ŌČ»¹ĢµŖ£ŗN2+2O2 |
B | ³ÉÓļ”°µĪĖ®ŹÆ“©”± | °üŗ¬CaCO3+CO2+H2O=Ca(HCO3)2 |
C | ”¶Ä¾²Ż¾¼Æ×¢”·¼ĒŌŲ”°ĒæÉÕÖ®£¬×ĻĒąŃĢĘš£¬ŌĘŹĒÕęĻõŹÆŅ²”£”± | ”°ĻõŹÆ”±ĪŖKNO3£¬¼ŲŌŖĖŲµÄŃęÉ«·“Ó¦ĪŖ×ĻÉ« |
D | Ņ°ĶāÖ®¹ķĮ×£¬Ę仚ɫĒą£¬ĘäדČē¾ę£¬»ņ¾Ū»ņÉ¢£¬Ė×³Ę¹ķ»š£¬ŹµÄĖÖīŃŖÖ®Į×¹āŅ²”£ | ”°Į×¹ā”±ŹĒÖøĮ×»ÆĒā(PH3)×ŌČ¼£¬½«»ÆѧÄÜ×Ŗ»ÆĪŖ¹āÄÜ |
A.AB.BC.CD.D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(I)ijĪĀ¶ČŹ±£¬ŌŚ2 LµÄČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£ĒėĶعż¼ĘĖć»Ų“šĻĀĮŠĪŹĢā”£
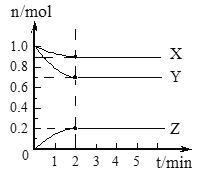
(1)ĮŠŹ½¼ĘĖć·“Ó¦æŖŹ¼ÖĮ2 min£¬YµÄĘ½¾ł·“Ó¦ĖŁĀŹ___________”£
(2)·ÖĪöÓŠ¹ŲŹż¾Ż£¬Š“³öX”¢Y”¢ZµÄ·“Ó¦·½³ĢŹ½___________”£
(3)ÓÉĶ¼ÖŠæ“³ö£ŗ________·ÖÖÓŗó£¬A”¢B”¢Cø÷ĪļÖŹµÄĪļÖŹµÄĮæ²»ŌŁĖꏱ¼ä¶ų±ä»Æ£¬ĖµĆ÷ŌŚÕāøöĢõ¼žĻĀ£¬øĆ·“Ó¦ŅŃ“ļµ½ĮĖ________________דĢ¬”£
(II)½«“æŠæʬŗĶ“æĶʬ°“ČēĶ¼ĖłŹ¾·½Ź½²åČė100 mLĻąĶ¬ÅØ¶ČµÄĻ”ĮņĖįÖŠŅ»¶ĪŹ±¼ä£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
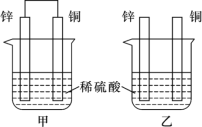
¢ŁĻĀĮŠĖµ·ØÕżČ·µÄŹĒ____________(Ģī×ÖÄø“śŗÅ)”£
A£®¼×”¢ŅŅ¾łĪŖ»ÆѧÄÜ×Ŗ±äĪŖµēÄܵÄ×°ÖĆ
B£®ŅŅÖŠĶʬÉĻƻӊĆ÷ĻŌ±ä»Æ
C£®¼×ÖŠĶʬ֏Įæ¼õÉŁ”¢ŅŅÖŠŠæʬ֏Įæ¼õÉŁ
D£®Į½ÉÕ±ÖŠČÜŅŗµÄpH¾łŌö“ó
¢ŚŌŚĻąĶ¬Ź±¼äÄŚ£¬Į½ÉÕ±ÖŠ²śÉśĘųÅŻµÄĖŁ¶Č£ŗ¼×____ŅŅ(Ģī”°£¾”±”¢”°£¼”°»ņ”°£½”±)”£
¢ŪĒėŠ“³öĶ¼ÖŠ¹¹³ÉŌµē³ŲµÄ×°ÖĆÕż¼«µÄµē¼«·“Ó¦Ź½______________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆŃ§Ę½ŗā³£ŹżKµÄŹżÖµ“󊔏ĒŗāĮæ»Æѧ·“Ó¦½ųŠŠ³Ģ¶ČµÄ±źÖ¾£¬ĻĀĮŠ·“Ó¦µÄĘ½ŗā³£ŹżŹżÖµČēĻĀ£ŗ
2NO£Øg£© N2£Øg£©+ O2£Øg£© K1=1”Į1030
2H2£Øg£©+ O2£Øg£© 2H2O£Øg£© K2=2”Į1081
2CO2£Øg£© 2CO£Øg£©+ O2£Øg£© K3=4”Į10©92
ŅŌĻĀĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
A. NO·Ö½ā²śÉśO2µÄ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K1=c(N2)c(O2)/c(NO)
B. Ė®·Ö½ā²śÉśO2£¬“ĖŹ±Ę½ŗā³£ŹżµÄŹżÖµŌ¼ĪŖ5”Į10©80
C. NO”¢H2O”¢CO2ČżÖÖ»ÆŗĻĪļ·Ö½ā·Å³öO2µÄĒćĻņÓɓ󵽊”µÄĖ³ŠņĪŖNO£¾H2O£¾CO2
D. ŅŌÉĻĖµ·Ø¶¼²»ÕżČ·
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æHagrmannõ„(H)ŹĒŅ»ÖÖŗĻ³É¶ą»·»ÆŗĻĪļµÄÖŠ¼äĢ壬æÉÓÉĻĀĮŠĀ·ĻßŗĻ³É(²æ·Ö·“Ó¦Ģõ¼žĀŌČ„)£ŗ
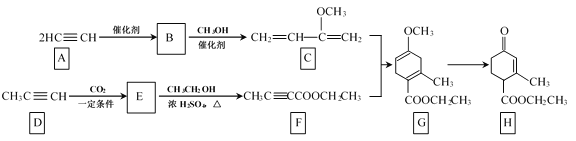
£Ø1£©BµÄ½į¹¹¼ņŹ½ŹĒ__£»B”śCµÄ·“Ó¦ĄąŠĶŹĒ__£»HÖŠŗ¬ÓŠµÄ¹ŁÄÜĶÅĆū³ĘŹĒōŹ»ł”¢___”£
£Ø2£©E”śFµÄ»Æѧ·½³ĢŹ½ŹĒ___”£
£Ø3£©TMOBŹĒHµÄĶ¬·ÖŅģ¹¹Ģ壬¾ßÓŠĻĀĮŠ½į¹¹ĢŲÕ÷£ŗ
¢Ł³ż±½»·Ķā½öÓŠ1ÖÖ»Æѧ»·¾³µÄHŌ×Ó£»
¢Ś“ęŌŚ¼×Ńõ»ł£ØCH3O”Ŗ£©”£
TMOBµÄ½į¹¹¼ņŹ½ŹĒ___”£
£Ø4£©ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ__”£
a.AÄÜŗĶHCl·“Ó¦µĆµ½¾ŪĀČŅŅĻ©µÄµ„Ģå
b.DŗĶFÖŠ¾łŗ¬ÓŠ2øö²»±„ŗĶ¶Č
c.1molGĶźČ«Č¼ÉÕÉś³É7molH2O
d.HÄÜ·¢Éś¼Ó³É”¢Č”“ś·“Ó¦
£Ø5£©ĒėŠ“³öŅŅČ²ŗĶHCHOĪŖÓŠ»śŌĮĻŗĻ³É µÄŗĻ³ÉĀ·ĻßĶ¼___£ØĪŽ»śŹŌ¼ĮČĪŃ”£©”£
µÄŗĻ³ÉĀ·ĻßĶ¼___£ØĪŽ»śŹŌ¼ĮČĪŃ”£©”£
ŅŃÖŖ£ŗ¢Ł”ŖC![]() CH+
CH+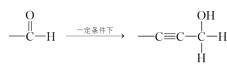
¢Ś”ŖCHO+
£ØŗĻ³ÉĀ·Ļß³£ÓƵıķŹ¾·½Ź½ĪŖ£ŗA![]() B
B![]() ””Äæ±ź²śĪļ£©
””Äæ±ź²śĪļ£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚøų¶ØĢõ¼žĻĀ£¬ĻĀĮŠŃ”ĻīĖłŹ¾µÄĪļÖŹ¼ä×Ŗ»Æ¾łÄÜŹµĻֵďĒ
A.Br2(g)![]()
B.![]()
C.Cu(s) ![]()
D.SiO2![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČ¼ĮĻµē³ŲŹĒÄæĒ°µē³ŲŃŠ¾æµÄČȵćÖ®Ņ»”£Ä³æĪĶāŠ”×é×ŌÖʵÄĒāŃõČ¼ĮĻµē³ŲČēĶ¼ĖłŹ¾£¬a”¢b¾łĪŖ¶čŠŌµē¼«ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ( )

A.a¼«ŹĒøŗ¼«£¬øƵē¼«ÉĻ·¢ÉśŃõ»Æ·“Ó¦
B.b¼«·¢ÉśµÄµē¼«·“Ó¦ŹĒO2+4OH--4e-=2H2O
C.µē³Ų×Ü·“Ó¦·½³ĢŹ½ĪŖ2H2+O2=2H2O
D.ĒāŃõČ¼ĮĻµē³ŲŹĒŅ»ÖÖ¾ßÓŠÓ¦ÓĆĒ°¾°µÄĀĢÉ«µēŌ“
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ĢÖÜĘŚÖ÷×åŌŖĖŲW”¢X”¢Y”¢ZµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ÓÉÕāĖÄÖÖŌŖĖŲŠĪ³ÉµÄŅ»ÖÖŃĪČÜŅŗ£¬Óöµ½FeCl3ČÜŅŗ³ŹĻÖŃŖŗģÉ«£¬øĆŃĪČÜŅŗÓėNaOHŌŚ¼ÓČČĢõ¼žĻĀ»įÉś³ÉŅ»ÖÖÄÜŹ¹ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶µÄĘųĢ唣ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.WŗĶXŠĪ³ÉµÄ»ÆŗĻĪļŌŚ³£ĪĀĻĀ¾łĪŖĘųĢ¬
B.XŌŖĖŲæÉŅŌŠĪ³É¶ąÖÖ¾ßÓŠ¹ć·ŗÓĆĶ¾µÄµ„ÖŹ
C.XŗĶZµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļ¶¼ŹĒĒæĖį
D.YµÄ¼ņµ„Ąė×ÓÓėZµÄ¼ņµ„Ąė×Ó¾ßÓŠĻąĶ¬µÄµē×Ó²ć½į¹¹
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com