
����Ŀ���ҹ���ѧ�Һ�°������������Ƽ��Ϊ�����Ƽҵ�����˾��ס���ͼΪ�����Ƽ����Ҫ���̣�������������ȥ����
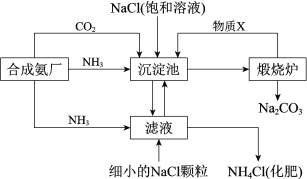
���ϣ������������еķ�ӦΪNaCl+CO2+NH3+H2O=NaHCO3��+NH4Cl
�����ܽ��
���� | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
20��C�ܽ��/g | 36.0 | 21.7 | 9.6 | 37.2 |
��1������¯�з�Ӧ�Ļ�ѧ����ʽ��___������X��___���ѧʽ����
��2������˵����ȷ����__������ĸ����
A������������NaHCO3��������Ϊһ��������NaHCO3���ܽ����С
B����Һ����Ҫ����NaCl��Na2CO3��NH4Cl
C�����ѭ����Ŀ�������ԭ�ϵ�������
��3����ҵ���ô�������ռ�����ijЩ������Ʒ�����ñ��ʹ�����Һ��Cl2��Ӧ���Ƶ�һ�������������г�����Ư�ס����������ʣ�ͬʱ��NaHCO3���ɣ��÷�Ӧ�Ļ�ѧ����ʽ��___��
��4��ij������Ʒ�к�����NaCl��ȡ����Ϊag����Ʒ������������ϡ���ᣬ��ַ�Ӧ���ȡ����ɡ����գ��õ�bg�������ʣ������Ʒ��Na2CO3����������Ϊ__��
���𰸡�2NaHCO3![]() Na2CO3+CO2��+H2O CO2 AC 2Na2CO3+Cl2+H2O=NaCl+NaClO+2NaHCO3
Na2CO3+CO2��+H2O CO2 AC 2Na2CO3+Cl2+H2O=NaCl+NaClO+2NaHCO3 ![]() ��100%
��100%
��������
��1���������еķ�ӦΪNaCl+CO2+NH3+H2O=NaHCO3��+NH4Cl��������¯�жԳ������γɵ�̼�����ƽ��и������շֽ�����̼���ơ�������̼��ˮ������ͼʾ����¯�в���������X�����ڳ����ص�ѭ��ʹ�ã�������X��CO2��
��2��A. ��������ṩ���ܽ�ȱ������ϣ�����������NaHCO3��������Ϊһ��������NaHCO3���ܽ����С��
B. �������еķ�ӦΪNaCl+CO2+NH3+H2O=NaHCO3��+NH4Cl�����˺���Һ����Ҫ���е���NH4Cl��
C. �����غ�����¯�з�Ӧ�õ��IJ��ﶼ����Ϊ��ȡ�����ԭ�ϣ������ѭ����Ŀ�������ԭ�ϵ������ʣ�
��3���������⣬�ɽ���Ӧ������������������������ˮ��Ӧ��������ʹ����ᣬ����ʹ���������̼������Һ��Ӧ���ɴ������ƺ�̼�����ƣ�
��4��ag����Ʒ������������ϡ���ᣬ̼�����������ַ�Ӧ�������Ȼ��ƣ���Ӧ����ʽΪNa2CO3+2HCl�T2NaCl+H2O+CO2�������ȡ����ɡ����գ��õ�bg��������Ϊ�Ȼ��ơ����ݷ�Ӧǰ����ԭ���غ㣬������NaCl�����ʵ���Ϊxmol��̼���Ƶ����ʵ���Ϊymol����
58.5x+106y=a��x+2y=![]() �����y=
�����y=![]() mol��̼���Ƶ�����=nM=
mol��̼���Ƶ�����=nM=![]() mol��106g/mol=
mol��106g/mol=![]() g�������Ʒ��Na2CO3����������Ϊ=
g�������Ʒ��Na2CO3����������Ϊ=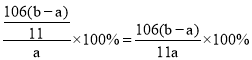 ��
��
��1���������еķ�ӦΪNaCl+CO2+NH3+H2O=NaHCO3��+NH4Cl��������¯�жԳ������γɵ�̼�����ƽ��и������շֽ�����̼���ơ�������̼��ˮ����ѧ����ʽ��2NaHCO3![]() Na2CO3+CO2��+H2O������ͼʾ����¯�в���������X�����ڳ����ص�ѭ��ʹ�ã�������X��CO2��
Na2CO3+CO2��+H2O������ͼʾ����¯�в���������X�����ڳ����ص�ѭ��ʹ�ã�������X��CO2��
�ʴ�Ϊ��2NaHCO3![]() Na2CO3+CO2��+H2O��CO2��
Na2CO3+CO2��+H2O��CO2��
��2��A. ��������ṩ���ܽ�ȱ������ϣ�����������NaHCO3��������Ϊһ��������NaHCO3���ܽ����С����A��ȷ��
B. �������еķ�ӦΪNaCl+CO2+NH3+H2O=NaHCO3��+NH4Cl�����˺���Һ����Ҫ���е���NH4Cl����B����
C. �����غ�����¯�з�Ӧ�õ��IJ��ﶼ����Ϊ��ȡ�����ԭ�ϣ������ѭ����Ŀ�������ԭ�ϵ������ʣ���C��ȷ��
�ʴ�ΪAC��
��3���������⣬�ɽ���Ӧ������������������������ˮ��Ӧ��������ʹ����ᣬ����ʹ���������̼������Һ��Ӧ���ɴ������ƺ�̼�����ƣ���Ӧ�Ļ�ѧ����ʽ��2Na2CO3+Cl2+H2O=NaCl+NaClO+2NaHCO3��
�ʴ�Ϊ��2Na2CO3+Cl2+H2O=NaCl+NaClO+2NaHCO3��
��4��ag����Ʒ������������ϡ���ᣬ̼�����������ַ�Ӧ�������Ȼ��ƣ���Ӧ����ʽΪNa2CO3+2HCl�T2NaCl+H2O+CO2�������ȡ����ɡ����գ��õ�bg��������Ϊ�Ȼ��ơ����ݷ�Ӧǰ����ԭ���غ㣬������NaCl�����ʵ���Ϊxmol��̼���Ƶ����ʵ���Ϊymol����
58.5x+106y=a��x+2y=![]() �����y=
�����y=![]() mol��̼���Ƶ�����/span>=nM=
mol��̼���Ƶ�����/span>=nM=![]() mol��106g/mol=
mol��106g/mol=![]() g�������Ʒ��Na2CO3����������Ϊ=
g�������Ʒ��Na2CO3����������Ϊ=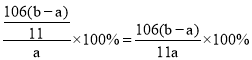 ��
��
�ʴ�Ϊ��![]() ��100%��
��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����373Kʱ����0.5mol N2O4����ͨ�����Ϊ5L�ĺ����ܱ�������,�������ֺ���ɫ����Ӧ���е�2��ʱ,NO2��Ũ��Ϊ0.02 mol/L����60��ʱ,��ϵ�Ѵ�ƽ��,��ʱ������ѹǿΪ��ʼʱ��1.6��������˵����ȷ���ǣ� ��
A. ǰ2�룬��N2O4��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.01mol/(L��s)
B. ��2��ʱ��ϵ�ڵ�ѹǿΪ��ʼʱ��1.2��
C. ��ƽ��ʱ��ϵ�ں�N2O40.20mol
D. ƽ��ʱ������ٳ���һ����N2O4, ������N2O4��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ���ܴﵽʵ��Ŀ����(�г�����δ����)
A.  ���ڼ�����������ȥ���ɵ���ϩ
���ڼ�����������ȥ���ɵ���ϩ
B.  ����ʯ�͵ķ���
����ʯ�͵ķ���
C.  ����ʵ������������
����ʵ������������
D.  ��֤�����ԣ����̼�����
��֤�����ԣ����̼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������NaClO3��H2SO4��SO2��H2O2��NaOHΪԭ�ϣ��Ʊ�NaClO2����ˮNa2SO4������Ҫ�������£�

��֪���� 2ClO2��H2O2��2NaOH=2NaClO2��O2��2H2O��
�� 2ClO2��2NaOH=NaClO2��NaClO3��H2O��
���¶ȸ���60 ��ʱ��NaClO2�����ֽ�����NaClO3��NaCl��
(1)��Ӧ1��SO2��NaClO3��Ӧ�Ƶ�ClO2���壬�÷�Ӧ�Ļ�ѧ����ʽΪ________��
(2)��ͼ1��ʾװ���з�����Ӧ2����NaClO2����Ӧ�����зų��������ȡ�
���о�������ʵ��ʱ����Һ��H2O2��NaOH�����ϱ���Ҫ������0.8���ң�ԭ�������____________________________________________________��
��������Һ��H2O2��NaOH�����ϱȡ�Ũ�Ⱥ��������������£����Ʒ�Ӧ��0��3 �����У�ʵ���пɲ�ȡ�Ĵ�ʩ��______________________��
��װ������������________________________��

(3) ĸҺ2������ѹ��������ȴ�ᾧ�Ȳ������NaClO2�ֲ�Ʒ��ʵ���в��ü�ѹ������ԭ����________________________________________________��
(4) Na2SO4���ܽ��������ͼ2��ʾ���벹��������ĸҺ1�Ʊ���ˮNa2SO4��ʵ�鷽����______________________________________________________________������ˮ�Ҵ�ϴ�ӣ�����õ���Ʒ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ�ֳ������������ַ�Ӧ�������������ȥ���Ը���ͼ��ת����ϵ���ش��������⡣
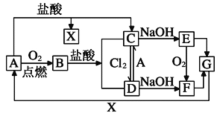
��1��B������Ϊ____��
��2������C��Һʱ���������A��ԭ����____��A��ˮ������Ӧ�Ļ�ѧ����ʽΪ____���÷�Ӧ��������____���������Ӧ���ͣ�
��3��E����F�ɹ۲쵽������____����ѧ����ʽΪ____��
��4��д��B��C��ѧ����ʽΪ____��C��D�����ӷ���ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶Ⱥ��ݻ�������ܱ������У�A������B���巴Ӧ����C���塣��Ӧ�����У���Ӧ�����������Ũ����ʱ��仯��������ͼ��ʾ��������������ȷ���ǣ� ��
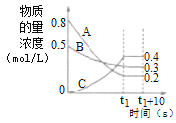
A.�÷�Ӧ�Ļ�ѧ����ʽΪA(g)+3B(g)2C(g)
B.(t1+10)sʱ�������¶ȣ������淴Ӧ���ʼӿ�
C.��t1sʱ��V��(A)��0
D.���÷�Ӧ�ھ��������н��У�Ҳ��t1ʱ�̴ﵽƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaCl��������100mL2.0mol��L1NaCl��Һ����ش��������⡣
��1���õ��������У�������ƽ��ҩ�ס���Ͳ���ձ�������������ͷ�ιܺ�__��
��2����������ƽ��ȡNaCl�����������__g��
��3����������У���ʹ������ҺŨ��ƫ�ߵ���__������ĸ����
A������ʱ�����ӿ̶��� B��ת��Һ��ʱ��������Һ������
C��������ˮ�����˿̶��� D��û��ϴ���ձ��Ͳ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС����̽��Fe2+���ʵ�ʵ���й۲쵽�쳣����
ʵ��� | ���� |
| ��Һ��죬Ƭ�̺�ɫ��ȥ�����������ɣ�������ΪO2���� |
���ϣ�����Fe3++3SCN��=Fe(SCN)3����ɫ����Fe(SCN)3��SԪ�صĻ��ϼ�Ϊ2��
����BaSO4�Dz���������İ�ɫ����
��1��ʵ���������Fe2+��__�ԣ���ȫH2O2��FeCl2������Һ��Ӧ�����ӷ���ʽ��__Fe2+ +__H2O2+__H+ =__Fe3++__H2O
��2��̽������ɫ��ȥ����ԭ����ʵ�����ɫ�����Һ�����ݷֱ����ʵ�顣

ʵ���ó��Ľ����ǣ���ɫ��ȥ��ԭ����__��
��3��Ϊ��һ��̽������ɫ��ȥ����ԭ������ʵ���
ʵ��� | ���� |
| ��Һ��죬һ��ʱ�����ɫ�� |
ȡ������Ӧ�����Һ���μ������BaCl2��Һ | �ް�ɫ���������� |
������������ʵ�飬����������ȷ����__������ĸ����
A��ʵ����з�����������ԭ��Ӧ��4Fe2++O2+4H+=4Fe3++2H2O
B��ͨ��ʵ����Ƴ�ʵ���������FeCl2��ֻ��O2
C��O2�ڸ�ʵ�������²���ʹ��ɫ��Һ��ɫ
D��ʵ����к�ɫ��ȥ��H2O2���������й�
��4������ʵ��̽�������õ���ʵ�鷽����__��д��һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(TiO2����缫Ƕ�뵽���������ӵ�ص����������ڹ���ƵIJ�������صij���λ�½����ù�缫�������ʱ�Ĺ���ԭ����ͼ��ʾ������˵���������

A.���ʱ�����ĵ缫��ӦʽΪ3I--2e-=I3-
B.�ŵ�ʱ��a������������Ӧ
C.�ŵ�ʱ������������Ӧ������Ŀ��Ϊ4��3
D.�������ʱ������ת��Ϊ���ܣ���ת��Ϊ��ѧ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com