
X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17.请填空(用元素符号或化学用语):
(1)Y是 ,Z是 ,W是 ;
(2)Y元素的最高价氧化物的化学式是 ,其对应的水化物分子式是 ;
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1.该化合物的化学式 4,其中存在的化学键类型有 ;
(4)上述四种元素中,非金属性最强的是 ,非金属性最弱的是 .
| 位置结构性质的相互关系应用. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | 若Y、Z、W三者处于同一周期或同一主族,最外层电子数之和不可能为17,处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有:
设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理,由于Y是N元素,那么X只能是位于其前面的H、He、Li、Be、B五种元素,X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1,化合物中硫原子与氧原子个数之比为1:4,为硫酸根,化合物中x原子与氮原子个数之比为4:1,且x的原子序数比氮原子小,则X为H,X与N形成铵根离子,结合对应单质化合物的性质解答该题. |
| 解答: | 解:(1)若Y、Z、W三者处于同一周期或同一主族,最外层电子数之和不可能为17,处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有:
设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理,由于Y是N元素,那么X只能是位于其前面的H、He、Li、Be、B五种元素,X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1,化合物中硫原子与氧原子个数之比为1:4,为硫酸根,化合物中x原子与氮原子个数之比为4:1,且x的原子序数比氮原子小,则X为H,X与N形成铵根离子, 故答案为:N;O;S; (2)Y为N,Y元素的最高价氧化物的化学式是N2O5,其对应的水化物分子式是HNO3, 故答案为:N2O5;HNO3; (3)化合物中硫原子与氧原子个数之比为1:4,为硫酸根,化合物中x原子与氮原子个数之比为4:1,且x的原子序数比氮原子小,则X为H,X与N形成铵根离子,所以该化合物为硫酸铵,其化学式为(NH4)2SO4,其中存在的化学键类型有离子键和共价键, 故答案为:(NH4)2SO4;离子键和共价键; (4)根据元素周期律,在N、O、S、H中,非金属性最强的是O,非金属性最弱的是H, 故答案为:O;H; |
| 点评: | 本题考查学生对元素结构与位置性质关系的利用,难度不大,关键在确定元素Y、Z、W的可能位置,利用最外层电子数之和为17推断. |


科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.离子化合物中一定不含共价键,共价化合物中一定不含离子键
B.含有离子键的化合物一定是离子化合物 C.含有共价键的物质一定是共价化合物
D.分子间作用力越大,分子的热稳定性就越大
| D | ||
| A | B | C |
| E |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列三种化合物的结构简式:

请认真观察后回答下列问题:
(1)写出肉桂酸分子中官能团的名称: .
(2)以上三种化合物中不能够和NaHCO3溶液反应生成CO2的是 (写名称).
(3)乙酰水杨酸与NaOH溶液反应,1mol该有机物最多可消耗NaOH mol,其反应方程式为: .
(4)可用于鉴别以上三种化合物的一组试剂是 .
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液
A.②与③B.②与④C.①与④D.①与②
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y两种金属,下列能说明X的金属性强于Y的金属性的组合是( )
①X的最高价氧化物的水化物的碱性强于Y的最高价氧化物的水化物的碱性
②X能置换出CuSO4溶液中的Cu,Y投入CuSO4溶液中无任何现象出现
③将X、Y用导线连接一起插入H2SO4溶液中,Y上冒大量气泡
④用碳棒电极电解含X、Y两种金属离子的盐溶液时,一开始析出的是金属Y
⑤X单质能从Y的硫酸盐溶液中置换出Y单质.
|
| A. | ①④⑤ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知R2﹣的核内有x个中子,R的质量数为M,则m g R2﹣含有电子的物质的量为( )
|
| A. | (M﹣x+2)mol | B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各实验装置的叙述中,不正确的是
A.图①可用于实验室制备少量Cl2或NH3
B.可用从a处加水的方法检验装置②的气密性
C.实验室也可以用装置③收集HCl气体
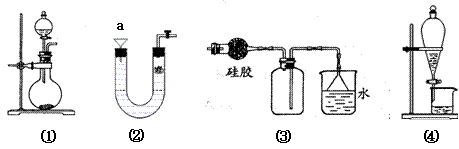 D.装置④可用于苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗上口倒出
D.装置④可用于苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: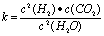 它所对应的化学反应为:
它所对应的化学反应为:
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母)。
A. =0.8 mol·L-1 B. =1.4 mol·L-1 C. <1.4 mol·L-1 D. >1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母)。
A. 0.6 mol 1.0 mol 0.5 mol 1.0 mol B. 0.6 mol 2.0 mol 0 mol 0 mol
C. 1.0 mol 2.0 mol 1.0 mol 2.0 mol D. 0.25 mol 0.5 mol 0.75 mol 1.5 mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:
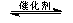 2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。
若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜
g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于能量转化的认识中错误的是( )
A.电解水生成氢气和氧气时,电能转化为化学能
B.绿色植物进行光合作用时,太阳能转化为化学能
C.电池充电是将电能转化为化学能
D.燃料电池的能量转化率可达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
MgCl2中的一种或几种,现进行如下实验:
(1)将白色固体溶于水中,得到无色透明溶液.
(2)取少量上述溶液两份,其中一份滴加BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀没有溶解.另一份溶液中滴加NaOH溶液,有白色沉淀生成.
根据以上实验现象可知,该白色固体中一定含有 ,一定没有 ,可能有 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com